Prioni - prion-taudin aiheuttajat
Viimeksi tarkistettu: 23.04.2024

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Hitailla virusinfektioilla on erityisiä kriteereitä:
- epätavallisen pitkä inkubaatioaika (kuukaudet, vuodet);
- eräänlainen elinten ja kudosten tappio, lähinnä keskushermosto;
- taudin hidas tahti;
- välttämätön tappava lopputulos.
Akuutin virusinfektioiden taudinaiheuttajat voivat myös aiheuttaa hitaita virusinfektioita. Esimerkiksi tuhkarokkovirus aiheuttaa joskus PSES: ää ja vihurirokkoa - progressiivista synnynnäistä ruplaa ja ruplaa panencefaliittia.
Tyypillinen eläinten hitaus virusinfektio aiheutuu retroviruksista tulevasta viruksen visna / mediista . Se on hitaasti virustartunnan ja progressiivisen lampaiden keuhkokuume. Aivojen valkoinen aine tuhoutuu , halvaantuminen kehittyy (visna - kuivuus); on krooninen tulehdus keuhkoihin ja pernaan.
Samankaltaiset sairaudet, jotka johtuvat hitaista virustartunnista, aiheuttavat prioneja - prion-infektioita. Prion-taudit ovat ryhmä ihmisen ja eläinten keskushermoston progressiivisia häiriöitä. Ihmiset ovat häirinneet keskushermoston toimintaa, muutoksia persoonallisuudessa, liikuntahäiriöitä. Taudin oireet kestävät yleensä useista kuukausista useisiin vuosiin, mikä johtaa kuolemaan. Aiemmin prion-infektioita tarkasteltiin yhdessä niin sanottujen hitaiden virusinfektioiden patogeenien kanssa.
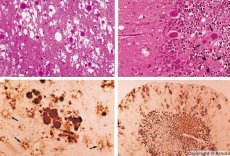
Jotkut aineet, jotka aiheuttavat prionitautien, kertyy ensin imukudoksissa. Prionit tunkeutumisen aivoihin, se kertyy suuria määriä, mikä aiheuttaa amyloidoosi (solunulkoinen disproteinoz tunnettu siitä, että amyloidin kertyminen kehittämisen kanssa surkastumista ja skleroosi kudosten) ja astrosytoosi (astrosyyttien glia proliferaatiota, giperprodukdiya glialnyh kuidut). Fibrillejä tai amyloidiproteiinin aggregaatteja ja aivojen spongiformisen muutos (tarttuvien BSE). Tämän seurauksena muutoksia käyttäytymisen häiriintynyt liikkeiden koordinointi, kehittyi fataali ehtyminen. Koskemattomuutta ei ole muodostettu. Prionisairauksien liittyvät konformationaalisten tautien, jotka kehittävät seurauksena virhelaskostumisen (rikkoo oikean konformaation) solun proteiinia tarvitaan normaaliin kehon toimintaa. Prionien siirtotie ovat vaihtelevia:
- Eläinperäiset rehut, tartuntaeläimet, raa'an naudan elinten ravintolisät jne.:
- siirto verensiirrolla, eläintuotteiden antaminen, elinten ja kudosten siirto, tartunnan saaneiden kirurgisten ja hammaslääketieteellisten instrumenttien käyttö;
- siirto immunobiologisten lääkeaineiden kautta (tiedetään infektoivan PrpP'''100 lampaan aivojen formulaavaccinesta sairailta lampailta).
Patologiset prionit, jotka ovat joutuneet suolistoon, kuljetetaan veriin ja imusolmukkeeseen. Kun perifeerinen replikaatio on perna, liite, risat ja muut imukudokset, ne siirretään aivoihin perifeeristen hermojen kautta (neuroinvasiasi). Todennäköisesti suoraan prionien tunkeutuminen aivoihin veri-aivoesteen kautta. Aikaisemmin uskottiin, että keskushermosto on ainoa kudos, jossa patologiset prioniet kerääntyvät, mutta tutkimukset ovat nousseet, jotka muuttivat tätä hypoteesia. Kävi ilmi, että perionsin kerääntyminen prioniin liittyy follikkelisten dendriittisolujen lisääntymiseen ja toimintaan.
Prionien ominaisuudet
Prioniproteiinin solu-normaali isoformi, jonka molekyylipaino on 33 - 35 kD, määritetään prioniproteiinigeenillä (Prion-geeni-PrNP on ihmisen 20. Kromosomissa). Solun pinnalla esiintyy normaalia geeniä (joka on ankkuroitu membraanille glykoproteiinimolekyylillä), se on herkkä proteaasille. Se säätelee hermopulssien, päiväkierrosten, hapettumisprosessien siirtoa, osallistuu kuparin aineenvaihduntaan keskushermostossa ja luuytimen kantasolujen jakautumisen säätelyssä . Lisäksi priongeeniä esiintyy perna, imusolmukkeet, iho, GIT ja folliculaariset dendriittisolut.
Patologisten prionien proliferaatio
Prionien muuttuminen muuttuneiksi muodoiksi tapahtuu, kun niiden välinen kinetiikka kontrolloitu tasapaino häiriintyy. Prosessi paranee, kun patologisen (PrF) tai eksogeenisen prionin määrä kasvaa. PrP on normaali proteiinin ankkuroitu solukalvoon. PrP 'on globulaarinen hydrofobinen proteiini, joka muodostaa aggregaatit itsensä ja PrF: n kanssa solun pinnalla: tuloksena PrP muutetaan PrF: ksi ja sykli jatkuu. PrF: n patologinen muoto kerääntyy hermosoluihin antaen solulle sponsiinisen ulkonäön.
Kuru
Prion-tauti, joka vallitsi ennen Papuans (käännetään vapinaa tai vapinaa) Uuden-Guinean saaren itäosassa. Taudin tarttuvien ominaisuuksien osoittautui K. Gaidushek. Ruuan aiheuttama aiheuttaja on rituaalisen kannibalismin seurauksena - syöminen riittämättömästi lämpökäsitellyillä, tartunnan saaneilla aivoihin kuolleilla sukulaisilla. Keskushermoston häviämisen seurauksena häiriintyy liikkeet, käynti, vilunväristykset, euforia ("naurettava kuolema"). Inkubaatioaika kestää 5-30 vuotta. Vuotta myöhemmin potilas kuolee.
Creutzfeldt-Jakobin tauti
Prionisairaudesta, joka virtaa dementian muoto, visuaalinen ja aivosairaudet ja liikehäiriöitä hengenvaarallisen taudin 4-5 kuukautta klassisen Creutzfeldt-Jakobin taudin ja (3-14 kuukautta, kun uusi muunnos Creutzfeld-Jakobin tauti. Itämisaika voi saavuttaa 20. On olemassa erilaisia tapoja infektioon ja taudin syihin:
- käytettäessä riittämättömästi lämpökäsiteltyjä eläinperäisiä tuotteita, esimerkiksi lihaa, aivotelejejä ja naudan spongiformisen enkefalopatian potilaita;
- kudossiirtoihin, esim. Sarveiskalvon, verensiirto, hormonien käyttöä ja muita biologisesti aktiivisia aineita, eläinperäisiä, käyttö katgutti, tai riittämättömästi prosterilinovannyh saastuneet kirurgiset instrumentit, manipulointi dissecting;
- PrP: n ja muiden sellaisten tilojen hyperproprimiseen, jotka stimuloivat PrP: n transformaatioprosessia PrF: ksi. "
Tauti voi myös kehittyä mutaation tai insertin seurauksena priongeenialueella. Taudin perherakenne on yleistä johtuen Creutzfeldt-Jakobin taudin geneettisestä taipumuksesta. Creutzfeldt-Jakobin taudin uuden version mukaan häiriöt kehittyvät nuoremmalla iällä (keski-ikä 28 vuotta), toisin kuin klassinen variantti (keski-ikä 65 vuotta). Kun uusi versio on Creutzfeldt-Jakobin taudin, epänormaali prioniproteiinin kertynyt paitsi CNS, ja mukaan lymforetikulaarisessa kudoksiin, mukaan lukien nielurisat.
Gerstmann-Streussler-Sheinker-oireyhtymä
Perinnöllinen Prion-tauti, joka ilmenee dementian, hypotension, nielemisen (dysfagia), dysartriassa. Usein on perhehahmo. Inkubaatioaika on 5 - 30 vuotta. Tauti ilmenee 50-60 vuodessa, sen kesto vaihtelee 5 - 13 vuoden välein.
Perinnöllinen kuolevainen unettomuus
Autoimmuunisairaus progressiivinen unettomuus, sympaattinen supistumisherkkyyttä (verenpainetauti, kuume, ihottuma, takykardia), vapina, ataksia, mnokloniyami, hallusinaatioita. Nukkuminen on voimakkaasti häiriintynyt. Kuolema tapahtuu sydän- ja verisuonitautien etenemisen kanssa.
Korjaa se
Scrapie (alkaen Englanti kaapia -. Kaavi) - prionitauti lampaiden ja vuohien (syyhy), joka vuotaa keskushermoston sairaus, etenevä sairaus liikkuvuus, voimakas kutina (kutina) ja päättyvät eläimen kuolemaan.
Naudan spongiforminen enkefalopatia
Nautaeläinten tauti, jolle on ominaista keskushermoston häviäminen, liikkeiden koordinoinnin rikkominen ja eläimen väistämätön kuolema. Ensimmäistä kertaa tautiepidemia puhkesi Isossa-Britanniassa. Se liittyi eläinten ruokintaan liha- ja luujauhoa sisältävien patologisten prionien kanssa. Inkubaatioaika vaihtelee 1,5: stä 15 vuoteen. Eniten tartunnan saaneet ovat eläinten pää, selkäytimet ja silmäpallot.
Prion-tautien laboratoriodiagnostiikka
Diagnoosiin spongiformisia muutoksia aivoissa, astrosytoosi (glioosi), tulehduksen infiltraattien puuttuminen. Aivot värjätään amyloidilla. Aivo-selkäydinnesteessä havaitaan prion-aivohäiriöiden proteiinimarkkereita (ELISA: n avulla). Prionigeenin (PCR) geneettinen analyysi suoritetaan.
Prionsairauksien profylaksia
Puhdistamista työkaluja ja ympäristön esineet suosittelemat autoklavoimalla (134 ° C: ssa 18 min 121 ° C: ssa 1 tunti)., Polttaminen, lisää valkaisuainetta käsittely ja odnonormalnym NaCl-liuoksessa 1 h epäspesifisen ehkäisyyn rajoitetaan käyttöä lääkkeiden eläinperäisten ja se kielsi tuotannon hormonien eläinten aivolisäkkeen. Rajoittaa kovakalvon transplantaation. Kun työskennellään nesteitä dialoginen potilaat käyttävät kumihanskat.


 [
[