Lääketieteen asiantuntija
Uudet julkaisut
Prionit - prionisairauksien aiheuttajat
Viimeksi tarkistettu: 06.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Hitaille virusinfektioille on ominaista erityiskriteerit:
- epätavallisen pitkä inkubointiaika (kuukausia, vuosia);
- elinten ja kudosten, pääasiassa keskushermoston, spesifinen vaurio;
- taudin hidas ja tasainen eteneminen;
- väistämätön kohtalokas lopputulos.
Jotkut akuutteja virusinfektioita aiheuttavat taudinaiheuttajat voivat aiheuttaa myös hitaita virusinfektioita. Esimerkiksi tuhkarokkovirus aiheuttaa joskus SSPE:tä, ja vihurirokkovirus aiheuttaa etenevää synnynnäistä vihurirokkoa ja vihurirokon panenkefaliittia.
Tyypillisen eläinten hitaan virusinfektion aiheuttaa visna/madi-virus, joka on retrovirus. Se aiheuttaa lampailla hitaan virusinfektion ja etenevän keuhkokuumeen. Aivojen valkean aineen tuhoutuu, kehittyy halvaus (visna - surkastuminen); keuhkoihin ja pernaan tulee krooninen tulehdus.
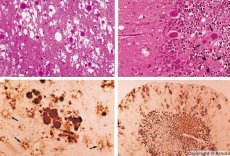
Hitaiden virusinfektioiden kaltaisia sairauksia aiheuttavat prionit - prioni-infektioiden aiheuttajat. Prionitaudit ovat joukko eteneviä ihmisten ja eläinten keskushermoston häiriöitä. Ihmisillä keskushermoston toiminta heikkenee, esiintyy persoonallisuuden muutoksia ja liikehäiriöitä. Taudin oireet kestävät yleensä useista kuukausista useisiin vuosiin ja päättyvät kuolemaan. Aiemmin prioni-infektioita pidettiin yhdessä niin sanottujen hitaiden virusinfektioiden aiheuttajien kanssa.
Jotkut prionisairauksia aiheuttavat tekijät kerääntyvät ensin imukudoksiin. Aivoihin joutuessaan prionit kerääntyvät suurina määrinä aiheuttaen amyloidoosia (solunulkoista dysproteinoosia, jolle on ominaista amyloidin kertyminen ja kudoksen surkastuminen ja skleroosi) ja astrosytoosia (astrosyyttisen neuroglian lisääntymistä, gliasolujen kuitujen liikatuotantoa). Muodostuu fibrillejä, proteiini- tai amyloidiaggregaatteja ja aivojen spongiformisia muutoksia (tarttuvat spongiformiset enkefalopatiat). Tämän seurauksena käyttäytyminen muuttuu, liikkeiden koordinaatio heikkenee ja kehittyy kuolemaan johtava uupumus. Immuunipuolustus ei muodostu. Prionisairaudet ovat konformaatiosairauksia, jotka kehittyvät elimistön normaalille toiminnalle välttämättömän soluproteiinin virheellisen laskostumisen (oikean konformaation rikkomisen) seurauksena. Prionien siirtymisreitit ovat erilaisia:
- ruoansulatuskanavan kautta - tartunnan saaneet eläinperäiset tuotteet, raa'ista naudan sisäelimistä peräisin olevat elintarvikelisäaineet jne.:
- tartunta verensiirron, eläinperäisten lääkkeiden antamisen, elin- ja kudossiirtojen sekä tartunnan saaneiden kirurgisten ja hammaslääketieteellisten instrumenttien käytön kautta;
- tartunta immunobiologisten valmisteiden välityksellä (tiedetään, että 1500 lampaalla on ollut PrP''-tartunta sairaiden lampaiden aivoformolirokotteella).
Suolistoon päästyä patologiset prionit kulkeutuvat vereen ja imusolmukkeisiin. Perifeerisen replikaation jälkeen pernassa, umpilisäkkeessä, nielurisoissa ja muissa imukudoksissa ne siirtyvät aivoihin ääreishermojen kautta (neuroinvaasio). Prionien suora tunkeutuminen aivoihin veri-aivoesteen läpi on mahdollista. Aiemmin uskottiin, että keskushermosto on ainoa kudos, johon patologiset prionit kerääntyvät, mutta on ilmestynyt tutkimuksia, jotka ovat muuttaneet tätä hypoteesia. Kävi ilmi, että prionien kertyminen pernaan liittyy follikulaaristen dendriittisolujen lisääntymiseen ja toimintaan.
Prionien ominaisuudet
Prioniproteiinin normaali soluisoformi, jonka molekyylipaino on 33–35 kDa, määräytyy prioniproteiinigeenin perusteella (prionigeeni PrNP sijaitsee ihmisen 20. kromosomissa). Normaali geeni esiintyy solun pinnalla (molekyylin glykoproteiinin ankkuroimana solukalvoon) ja on herkkä proteaasille. Se säätelee hermoimpulssien välittymistä, vuorokausisyklejä, hapetusprosesseja, osallistuu kuparin aineenvaihduntaan keskushermostossa ja luuytimen kantasolujen jakautumisen säätelyyn. Lisäksi prionigeeniä löytyy pernasta, imusolmukkeista, ihosta, ruoansulatuskanavasta ja follikkelidendriittisoluista.
Patologisten prionien lisääntyminen
Prionien muuttuminen muuttuneiksi muodoiksi tapahtuu, kun niiden välinen kineettisesti kontrolloitu tasapaino häiriintyy. Prosessia tehostaa patologisen (PrP) tai eksogeenisen prionin määrän lisääntyminen. PrP on normaali proteiini, joka on ankkuroitunut solukalvoon. PrP' on pallomainen hydrofobinen proteiini, joka muodostaa aggregaatteja itsensä ja PrP'':n kanssa solun pinnalle: seurauksena PrP' muuttuu PrP'':ksi ja sykli jatkuu. PrP'':n patologinen muoto kertyy hermosoluihin, jolloin solu saa sienimäisen ulkonäön.
Kuru
Prionitauti, aiemmin yleinen papualaisten keskuudessa (merkitys vapina tai tärinä) Uuden-Guinean saaren itäosassa. Taudin tarttuvat ominaisuudet todisti K. Gajdusek. Taudinaiheuttaja leviää ruoan välityksellä rituaalisen kannibalismin seurauksena - syömällä kuolleiden sukulaisten riittämättömästi kypsennettyjä, prioneilla saastutettuja aivoja. Keskushermoston vaurioitumisen seurauksena liikkuminen ja kävely heikkenevät, ilmenee vilunväristyksiä ja euforiaa ("naurukuolema"). Itämisaika kestää 5-30 vuotta. Potilas kuolee vuoden kuluttua.
Creutzfeldt-Jakobin tauti
Prionitauti, joka ilmenee dementiana, näkö- ja pikkuaivohäiriöinä sekä liikehäiriöinä ja johtaa kuolemaan 4–5 kuukauden sairauden jälkeen Creutzfeldt-Jakobin taudin klassisessa variantissa ja 3–14 kuukauden kuluttua Creutzfeldt-Jakobin taudin uudessa variantissa. Itämisaika voi olla jopa 20 vuotta. Erilaiset tartuntareitit ja taudin syyt ovat mahdollisia:
- kun nautitaan riittämättömästi lämpökäsiteltyjä eläintuotteita, kuten naudan spongiformista enkefalopatiaa sairastavien lehmien lihaa ja aivoja;
- kudossiirtojen aikana, kuten sarveiskalvon siirto, verensiirto, hormonien ja muiden eläinperäisten biologisesti aktiivisten aineiden käyttö, katgutin käyttö, saastuneet tai riittämättömästi steriloidut kirurgiset instrumentit, prosektoriset manipulaatiot;
- PrR:n liikatuotannon ja muiden PrR:n muuntumista PrR:ksi stimuloivien tilojen yhteydessä
Tauti voi kehittyä myös prionigeenin alueen mutaation tai insertion seurauksena. Taudin perinnöllinen luonne on yleinen Creutzfeldt-Jakobin taudin geneettisen alttiuden vuoksi. Creutzfeldt-Jakobin taudin uudessa variantissa sairaudet kehittyvät nuoremmalla iällä (keski-ikä 28 vuotta), toisin kuin klassisessa variantissa (keski-ikä 65 vuotta). Creutzfeldt-Jakobin taudin uudessa variantissa poikkeava prioniproteiini kerääntyy paitsi keskushermostoon myös imusuonten kudoksiin, mukaan lukien nielurisat.
Gerstmann-Sträussler-Scheinker-oireyhtymä
Perinnöllinen prionitauti, johon liittyy dementiaa, hypotoniaa, nielemisvaikeuksia (dysfagiaa) ja dysartriaa. Usein perinnöllinen. Itämisaika on 5–30 vuotta. Tauti puhkeaa 50–60 vuoden iässä ja sen kesto vaihtelee 5–13 vuodesta.
Perinnöllinen kuolemaan johtava unettomuus
Autoimmuunisairaus, johon liittyy etenevää unettomuutta, sympaattista yliaktiivisuutta (kohonnut verenpaine, hypertermia, hyperhidroosi, takykardia), vapinaa, ataksiaa, multiklonaalisia hermoja ja hallusinaatioita. Uni on vakavasti häiriintynyt. Kuolema tapahtuu sydän- ja verisuonisairauden etenemisen myötä.
Kaapia
Scrapie (englanninkielisestä sanasta scrape - kaapia) on lampaiden ja vuohien prionitauti (syyhy), joka ilmenee keskushermoston vaurioina, etenevinä liikehäiriöinä, voimakkaana ihon kutinana (syyhy) ja päättyy eläimen kuolemaan.
Naudan spongiforminen enkefalopatia
Nautakarjan sairaus, jolle on ominaista keskushermoston vaurio, liikkeiden koordinaation heikkeneminen ja eläimen väistämätön kuolema. Taudin epidemia puhkesi ensimmäisen kerran Isossa-Britanniassa. Se liittyi eläinten ruokkimiseen patologisia prioneja sisältävällä liha- ja luujauholla. Itämisaika vaihtelee 1,5–15 vuodesta. Eläinten aivot, selkäydin ja silmämunat ovat eniten tartunnan saaneita.
Prionitautien laboratoriodiagnostiikka
Diagnostiikan aikana havaitaan aivojen sienimäisiä muutoksia, astrosytoosia (glioosia) ja tulehdusinfiltraattien puuttumista. Aivot värjätään amyloidin varalta. Prionien aiheuttamien aivosairauksien proteiinimarkkereita havaitaan aivo-selkäydinnesteestä (ELISA:lla). Prionigeenin geneettinen analyysi (PCR) suoritetaan.
Prionitautien ehkäisy
Instrumenttien ja ympäristöesineiden dekontaminaatioon suositellaan autoklavointia (134 °C:ssa 18 min; 121 °C:ssa 1 h), polttoa, lisäkäsittelyä valkaisuaineella ja 1 tunnin ajan 1-normaalisella NaCl-liuoksella. Epäspesifisessä profylaksissa on asetettu rajoituksia eläinperäisten lääkevalmisteiden käytölle ja eläinperäisten aivolisäkehormonien tuotanto on kielletty. Kovakalvon siirto on rajoitettu. Potilaiden virtsanesteiden kanssa työskenneltäessä käytetään kumikäsineitä.


 [
[