Lääketieteen asiantuntija
Uudet julkaisut
Aivolisäkkeen anemia (kääpiökasvuisuus)
Viimeksi tarkistettu: 12.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
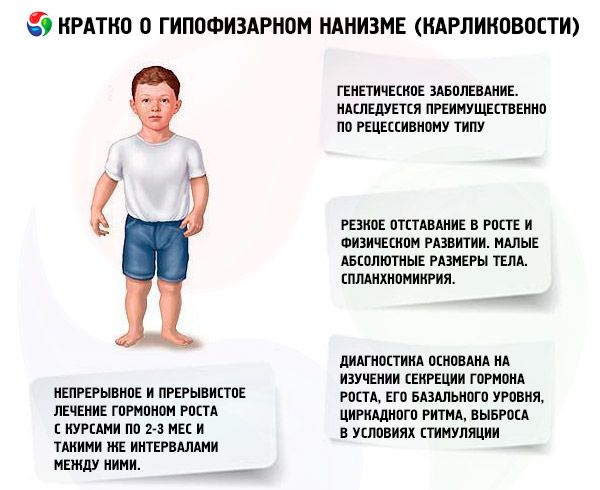
Termi "aivolisäkkeen lyhytkasvuisuus" (kreikan sanasta nanos - kääpiö; syn.: lyhytkasvuisuus, nanosomia, mikrosomia) tarkoittaa absoluuttisessa merkityksessä sairautta, jonka pääasiallinen ilmentymä on jyrkkä kasvun hidastuminen, joka liittyy aivolisäkkeen etulohkon kasvuhormonin erityksen häiriintymiseen.
Laajemmassa merkityksessä lyhytkasvuisuus on kasvun ja fyysisen kehityksen häiriö, jonka esiintyminen voi johtua paitsi aivolisäkkeen patologiasta johtuvasta somatotrooppisen hormonin absoluuttisesta tai suhteellisesta puutteesta, myös hypotalamuksen (aivojen) toimintojen säätelyn häiriöstä, somatotrooppisen hormonin biosynteesin häiriöistä ja kudosherkkyyden häiriöistä tälle hormonille.
Syyt kääpiökasvuisuus
Useimmat aivolisäkkeen lyhytkasvuisuuden muodot ovat geneettisiä sairauksia. Yleisin on panhypopituitaarinen lyhytkasvuisuus, joka periytyy pääasiassa resessiivisesti. Oletetaan, että tällä sairausmuodolla on kaksi periytymistapaa: autosomaalinen ja X-kromosomin kautta. Tässä lyhytkasvuisuuden muodossa somatotropiinin erityksen häiriintymisen ohella myös gonadotropiinien ja tyreotropiinin eritys häiriintyy useimmiten. ACTH:n eritys häiriintyy harvemmin ja vähäisemmässä määrin. Haiman polypeptidin kaltaisten vapauttavien hormonien, mukaan lukien synteettisen somatotropiinia vapauttavan hormonin (joka koostuu 29, 40 ja 44 aminohappotähteestä), toiminnalliset tutkimukset ovat osoittaneet, että useimmilla näistä potilaista on patologia hypotalamuksen tasolla, ja aivolisäkkeen etulohkon vajaatoiminta on toissijaista. Itse aivolisäkkeen primaarinen patologia on harvinaisempaa.
Venäjällä ja naapurimaissa esiintyy satunnaisesti geneettinen lyhytkasvuisuus, johon liittyy erillinen kasvuhormonin puutos, heikentynyt biologinen aktiivisuus ja herkkyys sille. Se on yleisempää Amerikan mantereella, Lähi-idän ja Keski-idän maissa sekä Afrikassa. Veren somatotrooppisen hormonin pitoisuutta ja potilaiden herkkyyttä eksogeeniselle somatotrooppiselle hormonille, immunoreaktiivisen insuliinin (IRI), insuliinin kaltaisten kasvutekijöiden (IGF) tyypin I (somatomediini C) ja tyypin II pitoisuutta sekä IGF-1:n vastetta somatotrooppisten hormonivalmisteiden hoitoon on tunnistettu kliinisesti samankaltaisten lyhytkasvuisuustyyppien erilaisia variantteja.
Äskettäin on selvitetty Laronin lyhytkasvuisuuden patogeneesi, jonka aiheuttaa IRF-1:n ja IRF-II:n puutos, sekä afrikkalaisilla pygmeillä esiintyvän lyhytkasvuisuuden patogeneesi, joka liittyy IRF-1:n ja IRF-II:n puutteeseen.
Vuonna 1984 kuvattiin uusi pseudo-aivolisäkkeen lyhytkasvuisuuden variantti, jolla oli korkea somatotrooppisen hormonin ja IGF-1:n taso; lyhytkasvuisuuden synty selittyy sen reseptorien vialla, mikä ilmenee ihon fibroblastien sitoutumisen jyrkkänä vähenemisenä IGF-1:een.
On korostettava, että nykyaikaisissa olosuhteissa pienten perheiden läsnä ollessa monet yksittäiset ("idiopaattiset", satunnaiset) tautitapaukset voivat olla myös geneettisiä.
350 sairauskertomuksen analyysissä lyhytkasvuisuuden etiologia oli epäselvä 228 potilaalla (65,2 %). Tähän ryhmään kuului potilaita 57 perheestä, joissa lyhytkasvuisuutta esiintyi toistuvasti (2–4 tapausta perhettä kohden), mikä oli 28 % kaikista potilaista. 77 %:lla perheistä, joilla oli etiologisesti epäselviä (pääasiassa geneettisiä) lyhytkasvuisuuden muotoja, todettiin kiistaton yhteys Rh-tekijän puuttumisen periytymiseen. Rh-tekijän jakautuminen lyhytkasvuisuuspotilaiden perheissä eroaa äidin ja sikiön välisen Rh-konfliktin yhteydessä havaitusta, eikä siihen yleensä liity vastasyntyneen hemolyyttistä sairautta (isä voi olla Rh-negatiivinen, ja vanhempien Rh-tekijän heterotsygoottisuuden tapauksessa lapset jne.). Voidaan olettaa yhteys somatotrooppisen hormonin (tai somatotropiinia vapauttavan hormonin) synteesistä vastaavien geenien ja Rh-tekijää määrittävien geenien välillä, varsinkin kun useimmat lyhytkasvuisuuden muodot ja Rh-tekijän puuttuminen ovat autosomaalisesti peittyviä piirteitä. Tämä ei selitä lyhytkasvuisuuden suhteellista harvinaisuutta verrattuna Rh-negatiivisten yksilöiden esiintyvyyteen väestössä. Todennäköisesti jotkin vielä tuntemattomat lisätekijät ovat tärkeitä, mutta Rh-tekijän jakautumisen piirteet perinnöllisen ja satunnaisen lyhytkasvuisuuden omaavien potilaiden perheissä eivät todennäköisesti ole sattumaa.
Suuri joukko lyhytkasvuisuuspotilaita (primaarinen aivo-, aivo-aivolisäke-) koostuu potilaista, joilla on erilaisia keskushermoston orgaanisia patologioita, jotka ovat syntyneet kohdussa tai varhaislapsuudessa. Tämän patologian anatominen aiheuttaja voi olla aivolisäkkeen alikehitys tai puuttuminen, sen dystopia turkkilaisen seinämän muodostumisen patologiassa, aivolisäkkeen kystinen rappeutuminen tai sen surkastuminen kasvaimen puristuksen vuoksi (kraniofaryngiooma, kromofobinen adenooma, meningeooma, gliooma). Lyhytkasvuisuus voi johtua hypotalamus-aivolisäke-alueen traumaattisista vammoista (kohdunsisäinen, synnytyksen tai postnataalin jälkeinen), joita esiintyy usein monisikiöraskauksissa, sekä synnytyksessä perätilassa, jalan asennossa tai poikittaisessa asennossa rotaatiossa jalan päällä (tämä on synnytyksen mekanismi yli 1/3:lla lyhytkasvuisuuspotilaista). Tartunta- ja toksiset vauriot ovat merkittäviä (kohdunsisäiset virusinfektiot, tuberkuloosi, kuppa, malaria, toksoplasmoosi; varhaisen iän sairaudet, vastasyntyneen sepsis, meningo- ja araknoenkefaliitti jne.). Nämä prosessit voivat vahingoittaa itse aivolisäkettä, sen toimintaa sääteleviä hypotalamuksen keskuksia ja häiritä keskushermoston normaaleja toiminnallisia yhteyksiä.
Sikiön kohdunsisäiset vauriot voivat johtaa sellaisten potilaiden syntymään, joilla on "syntymästä lähtien syntynyt kääpiökasvuisuus", mutta joiden kasvuhormonin eritys on normaalia (aivojen alkuaivokääpiökasvuisuus, mikrokefalia, Silver-Russell-kääpiökasvuisuus, johon liittyy kehon hemiasymmetria ja korkeat gonadotropiinipitoisuudet jne.).
Muita tekijöitä, jotka pahentavat fyysisen kehityksen häiriöitä lyhytkasvuisuudessa, voivat olla riittämätön ravitsemus, epätasapaino välttämättömien ainesosien (proteiinin puutos) ja mikroelementtien (sinkin puutos) suhteen, sekä epäsuotuisat ympäristöolosuhteet, samoin kuin erilaiset krooniset sairaudet, kuten glomerulonefriitti, jossa atsotemia vaikuttaa maksareseptorien aktiivisuuteen tai vaikuttaa suoraan maksasolujen aineenvaihduntaan, aiheuttaen somatomediinin synteesin vähenemistä tai maksakirroosia, kun somatomediinin muodostuminen on heikentynyt.
Synnyssä
Useimmilla aivolisäkkeen lyhytkasvuisuutta sairastavilla potilailla muutokset eivät rajoitu somatotrooppisen hormonin erityksen patologiaan ja herkkyyteen sille, vaan ulottuvat myös muihin aivolisäkkeen trooppisiin hormoneihin, mikä aiheuttaa erilaisia hormonaalisten ja aineenvaihduntahäiriöiden yhdistelmiä.
Eristetyssä somatotrooppisen hormonin puutoksessa aivolisäkkeen morfologisia muutoksia on tutkittu huonosti. Tutkituissa tapauksissa patologisia häiriöitä (kraniofaryngiooma tai kallon luiden hyperostoosi) havaittiin harvoin. Tällaisessa lyhytkasvuisuudessa voidaan havaita peptidergisten solujen synnynnäistä alikehittyneisyyttä tai hypotalamuksen välittäjäainejärjestelmän vikaa. Tällaisissa tapauksissa lyhytkasvuisuuteen voi liittyä näköhermojen dysplasiaa tai hypoplasiaa. Aivokalvon sisäiset kystat, aivolisäkkeen ja hypotalamuksen kasvaimet johtavat somatotrooppisen hormonin puutokseen, mikä aiheuttaa aivolisäkkeen kudoksen, erityisesti somatotrooppisten, puristumista.
Lyhytkasvuisuudelle on ominaista luiden oheneminen, joka johtuu pääasiassa kortikaalisesta kerroksesta, sekä luuston viivästynyt erilaistuminen ja luutuminen. Sisäelimet ovat hypoplastisia, joskus surkastumattomia, ja lihakset ovat heikosti kehittyneitä.
Oireet kääpiökasvuisuus
Jyrkkä kasvun ja fyysisen kehityksen viivästyminen ovat aivolisäkkeen lyhytkasvuisuuden tärkeimmät ilmenemismuodot. Potilaat syntyvät normaalipainoisina ja -pituisina, ja heidän kasvunsa alkaa jäädä jälkeen 2–4 vuoden iästä lähtien.
Ennen nanismin aktiivisen hoidon alkua kääpiöiksi katsottiin ne, joiden pituus oli naisilla alle 120 cm ja miehillä 130 cm. Tällä hetkellä kääpiön pituus eroaa vähintään 2-3 sigmapoikkeaman verran tietyn sukupuolen, iän tai populaation keskimääräisestä taulukkoarvosta. On myös olemassa menetelmä pituuden graafiseen arviointiin Gaussin jakaumakäyrän perusteella. Tässä tapauksessa pituuden mukaan kääpiöt sisällytetään ryhmään, joka sisältää vähimmäismäärän yksilöitä vastaavassa populaatiossa, joilla on suurin viive keskimääräisestä kasvunormista.
Aivolisäkkeen lyhytkasvuisuudelle on ominaista paitsi pieni absoluuttinen ruumiinkoko, myös pieni vuosittainen kasvu ja fyysisen kehityksen dynamiikka. Ruumiinrakenne on suhteellinen, mutta potilaiden kehon mittasuhteet ovat tyypillisiä lapsuudelle. Iho on vaalea, usein kellertävä ja kuiva, mikä johtuu kilpirauhasen absoluuttisesta tai suhteellisesta vajaatoiminnasta, joskus havaitaan syanoosia – ihon "marmoroitumista". Hoitamattomilla potilailla ilmenee varhain vanhanaikainen ja ryppyinen iho (geroderma). Tämä johtuu kilpirauhasen hormonin anabolisen vaikutuksen riittämättömyydestä ja solusukupolvien hitaasta vaihtumisesta.
Pään hiukset voivat olla normaaleja tai kuivia, ohuita ja hauraita; pitkät silmäripset ovat tyypillisiä. Toissijaista karvankasvua on usein poissa. Turkkilaisen seinämän koko useimmilla lyhytkasvuisuuspotilailla (70–75 %) ei ole muuttunut, mutta seinä säilyttää usein lapsellisen "seisovan" muodon, sillä on leveä "juveniili" selkä, ja kiilaluun sinus on jäljessä pneumatisaation suhteen. On kuitenkin potilaita, joilla turkkilainen seinämä on suurentunut, mikä on merkki kasvaimen olemassaolosta; sen taustalla tai sisäänkäynnin alueella on kalkkeutumisalueita (kraniofaryngioomassa, neuroinfektion jäännösvaikutuksissa) tai sen väheneminen (alikehityksen merkit, aivolisäkkeen pieni koko). Aivolisäkkeen paineen alenemisen oireita havaitaan: kallonholvin luiden oheneminen, lisääntynyt verisuonikuvio, sormenjälkien esiintyminen jne. Tärkein aivolisäkkeen lyhytkasvuisuuden merkki on luuston erilaistumisen ja luutumisen viivästyminen. Myös hammasjärjestelmän piirteet liittyvät läheisesti luuston erilaistumiseen: maitohampaiden myöhäinen korvautuminen on havaittavissa. Suurin viivästys luuston kehityksessä havaitaan potilailla, joilla on lyhytkasvuisuus, seksuaalinen vajaatoiminta ja kilpirauhasen vajaatoiminta.
Useimpien potilaiden sukupuolielimet ovat vakavasti alikehittyneet, vaikka epämuodostumat ovat harvinaisia. Havaitsimme kryptorkidismia 5,8 %:lla miespotilaista. Seksuaaliseen vajaatoimintaan liittyy toissijaisten seksuaalisten ominaisuuksien alikehittyneisyys ja heikentynyt seksuaalinen halu, kuukautisten puuttuminen. Normaali spontaani seksuaalinen kehitys havaitaan vain potilailla, joilla on erillinen kasvuhormonin puutos, ja joillakin aivojen lyhytkasvuisuutta sairastavilla potilailla.
Kilpirauhasen vajaatoiminta on melko yleinen lyhytkasvuisuuden oire. On huomattava, että kilpirauhasen vajaatoiminnan ulkoiset ilmentymät eivät aina heijasta kilpirauhasen todellista toiminnallista tilaa. Tämä johtuu suhteellisesta kilpirauhasen vajaatoiminnasta, joka johtuu tyroksiinin (T4) muuttumisen häiriintymisestä trijodityroniiniksi (T3 ) ja inaktiivisen (palautuvan)T3:n muodostumisesta, mikä on tyypillistä somatotrooppiselle vajaatoiminnalle.
Aivolisäkkeen lyhytkasvuisuudessa adrenokortikotrooppinen toiminta heikkenee harvemmin ja vähäisemmässä määrin kuin sukupuoli- ja kilpirauhasta stimuloivat toiminnot, eikä useimmilla potilailla vaadi erityistä korjausta.
Useimmissa tapauksissa äly ei ole heikentynyt. Tunnetason muutoksia esiintyy henkisen infantilismin muodossa; vanhemmilla potilailla, joilla ei ole älyllistä heikentymistä, havaitaan joskus reaktiivisia neurooseja.
Orgaanisessa aivopatologiassa, erityisesti kasvaimen luonteessa, lyhytkasvuisuus voi esiintyä diabeteksen insipiduksen, bitemporaalisen hemianopsian ja kehitysvammaisuuksien oireiden yhteydessä.
Tutkimus aivojen bioelektrisen aktiivisuuden kehityksestä potilailla, joilla ei ole keskushermoston orgaanisia oireita, osoitti, että heidän EEG:lleen on ominaista kypsymättömyyden piirteet, korkean "lapsellisen" EEG-jännitteen pitkäaikainen säilyminen; alfa-rytmin epätasaisuus amplitudissa ja taajuudessa; hitaiden θ- ja δ-rytmien määrän jyrkkä kasvu, erityisesti otsa- ja keskijohtimissa; selkeä reaktio hyperventilaatioon; EEG-rytmien alueen muutos valoärsytyksen rytmien jälkeen kohti matalia taajuuksia (todiste aivojen hermorakenteiden toiminnallisen liikkuvuuden vähenemisestä). Havaittiin, että iäkkäillä potilailla aivojen sähköisen aktiivisuuden kehittymättömyys johtuu seksuaalisesta alikehittyneisyydestä ja kaikenikäisillä potilailla kilpirauhasen vajaatoiminnasta.
Kääpiökasvupotilaiden hiilihydraattiaineenvaihdunnalle on ominaista taipumus laskea paastoverensokeritasoja, nousta fyysisen rasituksen aikana, endogeenisen insuliinin puutos, lisääntynyt herkkyys eksogeeniselle insuliinille ja usein hypoglykeemisten tilojen kehittyminen. Jälkimmäinen selittyy pääasiassa riittämättömillä vasta-ainehormonien tasoilla potilaiden elimistössä.
Sisäelimissä havaitaan splanknomykriaa eli koon pienenemistä. Lyhytkasvuisuudelle tyypillisiä sisäelinten toiminnallisia muutoksia ei ole kuvattu. Usein havaitaan valtimohypotensiota, johon liittyy systolisen ja diastolisen paineen lasku ja pulssin amplitudin pieneneminen. Sydänäänet ovat vaimeita, ja erityyppisiä toiminnallisia sivuääniä kuuluu sydänlihaksen troofisten muutosten ja autonomisen hermoston häiriöiden vuoksi. EKG:lle on ominaista matala sydänjänteys (erityisesti kilpirauhasen vajaatoiminnassa), sinusbradykardia tai bradyarytmia; PCG:ssä näkyy äänien amplitudin lasku, lisääänet ja toiminnalliset sivuäänet. Oxygemometriatiedot viittaavat hypoksemiaan (alkuvaiheessa ja fyysisen rasituksen aikana) ja happivelkaan. Iäkkäillä potilailla kehittyy joskus verenpainetauti.
Diagnostiikka kääpiökasvuisuus
Lyhytkasvuisuuden diagnoosi ja erotusdiagnoosi perustuvat anamneesiin ja kattavaan kliiniseen, radiologiseen, laboratorio- ja hormonaaliseen tutkimukseen. Potilaiden kasvun arvioimiseksi absoluuttisen koon lisäksi määritetään kasvuvaje – potilaan pituuden ja vastaavan sukupuolen ja iän keskiarvon välinen ero; kasvuikä – potilaan pituuden vastaavuus tiettyihin standardeihin; normalisoidun poikkeaman indikaattori.
I = M - Mcp / δ, jossa M on potilaan pituus, Mcp on tietyn sukupuolen ja iän keskimääräinen normaali pituus, δ on neliöpoikkeama Mcp:stä; I alle 3 on tyypillistä nanismille, I yli 3 on tyypillistä gigantismille. Tätä indikaattoria voidaan käyttää kehityksen dynamiikan arviointiin.
Lymfikasvupotilaiden röntgentutkimuksessa havaitaan merkkejä kallonsisäisestä paineesta, neuroinfektion jäännösvaikutuksista, kalkkeutumisista ja kraniosynostoosista. Aivolisäkkeen koon, muodon ja rakenteen tutkimista pidetään epäsuorana aivolisäkkeen kokoa kuvaavana indikaattorina. Yksi tärkeimmistä patologisen kasvun hidastumisen ilmenemismuodoista on luuston erilaistumisen häiriintyminen. Luuston kypsyysasteen arvioimiseksi määritetään luun (röntgenkuva) ikä, joka vastaa luukudoksen erilaistumista; luutumisvaje on luutumisen viiveaste normista (vuosina), luutumiskerroin on luuston iän jakaminen kronologisilla ja muilla parametreilla.
Nykyaikainen lyhytkasvuisuuden diagnostiikka on mahdotonta ilman somatotrooppisen hormonin erityksen, sen perustason, vuorokausirytmin ja stimulaation aikana tapahtuvan vapautumisen tutkimista. Useimmille aivolisäkkeen lyhytkasvuisuutta sairastaville potilaille on ominaista somatotrooppisen hormonin pitoisuuden alentuminen veriseerumissa. Radioimmunologisella menetelmällä määritettynä se on (eri kirjoittajien mukaan) (0,87±0,09) - (1,50±0,64) ng/ml, keskiarvon ollessa (3,81±0,29) ng/ml. Somatotrooppisen hormonin erityksen päivittäisen (vuorokausirytmin) rytmin tutkimus osoitti, että sen taso terveillä ihmisillä on suurimmillaan kahden ensimmäisen unitunnin aikana ja klo 4–6 aamulla. Lyhytkasvuisuudessa somatotrooppisen hormonin pitoisuus on myös alentunut näinä tunteina.
Somatotrooppisen toiminnan varantojen tutkimiseksi käytetään erilaisia stimulantteja, joilla tarkastellaan somatotrooppisen hormonin pitoisuutta ennen niiden antamista ja sen jälkeen. Tutkimukseen otetaan verta 30 minuutin välein 2-3 tunnin ajan. Somatotrooppisen hormonin vapautumista stimulaation jälkeen pidetään normaalina vähintään 7-10 ng/ml:aan asti, joskus se saavuttaa 20-40 ng/ml. Jos yhdessä näytteessä ei ole reaktiota, tehdään toistetut testit muilla stimulanteilla. Somatotrooppisen hormonin riittämättömyys katsotaan todistetuksi, jos somatotrooppista hormonia ei vapautu 2-3 eri näytteessä.
Yleisimmin käytetyt stimuloivat testit ovat: laskimonsisäisesti annettaessa 0,1 U (0,75–1,5 U) insuliinia potilaan painokiloa kohden ja saavutettaessa hypoglykemia (verensokeritason lasku 50 % alkuperäisestä tasosta), seerumin somatotrooppinen hormoni määritetään yllä olevan kaavan mukaisesti. Jos kehittyy vaikea hypoglykemia, testi keskeytetään ja potilaalle annetaan glukoosia laskimoon. Tämä on yleisin, klassinen diagnostinen menetelmä.
TRH annoksella 200-500 mikrog laskimoon. Tunnistaa tehokkaasti hormonivarastot, ei aiheuta komplikaatioita. Yhdessä insuliinitestin kanssa se mahdollistaa hypotalamus-aivolisäkejärjestelmän vaurion asteen arvioinnin. Positiivinen reaktio TRH:lle ilman insuliinia eli hypoglykemiaa osoittaa aivolisäkkeen ehjyyden ja vaurioita hypotalamuksen tasolla, negatiiviset reaktiot TRH:lle ja hypoglykemialle osoittavat aivolisäkkeen itsensä vaurioita.
TRH, LH-RH annoksella 300 mikrog laskimoon on samanlainen kuin edellinen.
Ihmisen SGH on haimasyövästä eristetyn biologisesti aktiivisen yhdisteen synteettinen analogi. Tällä hetkellä synteettistä SGH:ta on kolmea tyyppiä: 29, 40 ja 44 aminohappotähteellä. Sitä käytetään laskimoon annoksina 1–3 μg / kg potilaan painosta. STH:n vapautumista havaitaan 15–20 minuuttia antamisen jälkeen, ja testi on muita tehokkaampi endogeenisen kasvuhormonin varausten paljastamisessa. Positiivinen SGH-reaktio osoittaa hypotalamuksen somatotrooppisen toiminnan vauriotasoa ja ehjää aivolisäkettä; aminohapoilla (L-arginiinimonokloridi, ornitiini, tryptofaani, glysiini, leusiini) laskimoon annoksella 0,25–0,5 g / 1 kg potilaan painosta. Tehokas SGH-varastojen tutkimiseen. Voi aiheuttaa allergisia reaktioita.
L-dopa suun kautta annoksella 250–500 mikrog. Tehokas ja potilaiden hyvin sietämä.
Käytetään myös testejä glukagonin, bromiergokryptiinin (parlodel), lysiinivasopressiinin, klonidiinin ja annostellun polkupyöräergometrisen kuormituksen kanssa.
Somatotrooppisen toiminnan tilan tutkiminen on välttämätöntä paitsi lyhytkasvuisuuden diagnosoinnissa myös hoitomenetelmän perustellussa valinnassa, koska somatotropiinihoito on järkevää vain endogeenisen kasvuhormonin riittämättömyyden tapauksessa.
Lyhytkasvuisuuden diagnosoinnissa on erittäin tärkeää tutkia insuliinin kaltaisten kasvutekijöiden eli somatomediinien (erityisesti IGF-1:n eli somatomediini C:n) pitoisuutta – somatotrooppisen hormonin vaikutuksen välittäjiä kudostasolla. Tiedetään, että lyhytkasvuisuudessa somatomediini C:n pitoisuus on normaalia pienempi ja akromegaliassa suurempi. Laronin kuvaama lyhytkasvuisuuden muoto on sairaus, jossa kasvuhormonin tuotanto on normaalia, mutta IGF-1:n ja IGF-II:n muodostuminen on häiriintynyt. Tällaisten potilaiden hoito somatotropiinilla on turhaa.
Aivolisäkkeen somatotrooppisen toiminnan epäsuoria indikaattoreita ovat alkalisen fosfataasin aktiivisuus ja seerumin epäorgaanisen fosforin pitoisuus. Hyposomatotrooppisissa tiloissa nämä indikaattorit ovat vähentyneet. Panhypopituitaarisessa lyhytkasvuisuuden muodossa gonadotropiinien, usein TSH:n, eritys on vähentynyt, johon liittyy vastaava sukupuolirauhasten toiminnan heikkeneminen (androgeenien tai estrogeenien puutos), kilpirauhasen (T3- , T4- ja proteiineihin sitoutuneen jodin - PBI:n pitoisuuksien lasku,131I: n kertyminen kilpirauhaseen) ja lisämunuaisten (kortisolin ja 17-OCS:n määrän väheneminen plasmassa, 17-KC:n ja 17-OCS:n erittyminen virtsaan, lymfosytoosi) toiminnan heikkeneminen.
Kaikentyyppiselle aivolisäkkeen (hypotalamus-aivolisäke) geneettiselle lyhytkasvuisuudelle on ominaista autosomaalisesti resessiivisesti (useammin) tai autosomaalisesti dominanttisti periytyvien lasten toistuva sairaus perheessä, kasvun hidastuminen ja fyysinen kehitys 2–4 vuoden iästä alkaen vähintään 2–3 asteen viiveellä tietyn sukupuolen, iän ja populaation keskimääräisistä kasvunormeista, alhainen spontaani vuotuinen kasvudynamiikka ja viivästynyt luutuminen. Alhaisella kasvuhormonin tasolla (2–3 stimulaatiokokeessa alle 7 ng/ml) kasvuhormonihoito on erittäin tehokasta (antaa vähintään 7 cm pituuden kasvua vuodessa). Normaalilla tai korkealla kasvuhormonin tasolla (sen biologisella inaktiivisuudella) herkkyys hormonille voidaan säilyttää. Älykkyyden muutoksia ei havaita.
Geneettisessä lyhytkasvuisuudessa, jossa kudos on epäherkkä somatotrooppiselle hormonille, kliininen kuva on samanlainen kuin eristetyssä kasvuhormonin puutoksessa, mutta somatotropiinihoito on tehoton. Tässä ryhmässä voidaan erottaa seuraavat päämuodot IRF-tason mukaan: normaalipitoisuuksilla (IRF-reseptorin vika) ja alentuneella - Laronin tyyppinen lyhytkasvuisuus (IRF-1- ja IRF-II-puutos) sekä afrikkalaisilla pygmeillä esiintyvä tyyppi (IRF-1-puutos).
Aivojen lyhytkasvuisuudelle on ominaista yksittäiset perheen sairaudet, jotka liittyvät keskushermoston kohdunsisäiseen tai postnataaliseen vaurioon, ja joissa esiintyy ilmeisiä orgaanisia muutoksia keskushermostossa, usein yhdistettynä näköelimen patologiaan, diabeteksen insipiduksen esiintymiseen, gonadotrooppisten toimintojen säilymiseen ja älykkyyden muutoksiin.
Joihinkin sukurauhasten dysgeneesin ja ageneesien tyyppeihin liittyy huomattava lyhytkasvuisuus, erityisesti Shereshevsky-Turnerin oireyhtymään ja kivesten dysgeneesin oireyhtymän "Turneroid" (mosaiikki) muotoon. Sytogeneettiset tutkimukset (sukupuolikromatiini, karyotyyppi) auttavat erotusdiagnoosissa paljastamalla kromosomipoikkeavuuksia sekä somaattisen ja sukupuolisen kehityksen tyypillisiä poikkeavuuksia, endogeenisen somatotrooppisen hormonin normaalit tai kohonneet tasot ja somatotropiinihoidon epäherkkyyden.
Lyhytkasvuisuudesta esiintyvistä hormonaalisista häiriöistä tulisi erottaa primaarinen kilpirauhasen vajaatoiminta, jonka aiheuttavat synnynnäinen kilpirauhasen vajaatoiminta tai aplasia, sen dystopia, kilpirauhashormonien biosynteesin entsymaattiset häiriöt ja kilpirauhasen varhainen autoimmuunivaurio. Kaikissa näissä tiloissa vallitsevat kilpirauhasen vajaatoiminnan merkit, joihin liittyy korkea TSH-taso ja T4- ja T3-pitoisuuksien lasku veressä . Autoimmuuniperäisessä myksedeemassa verestä havaitaan vasta-aineita tyreoglobuliinille, kilpirauhaskudoksen mikrosomaalisille ja tumafraktioille, somatotrooppisen hormonin taso on normaali tai alentunut. Kliininen vaikutus voidaan saavuttaa kompensoimalla vain kilpirauhasen vajaatoimintaa.
Lyhytkasvuisuuteen liittyy ennenaikainen seksuaalinen kehitys ja adrenogenitaalinen oireyhtymä kasvuvyöhykkeiden varhaisen sulkeutumisen vuoksi; Itsenko-Cushingin tauti, joka esiintyy lapsuudessa glukokortikoidien somatotrooppisen hormonin eritystä estävän vaikutuksen ja niiden katabolisen vaikutuksen vuoksi; Mauriacin oireyhtymä - lyhytkasvuisuus ja infantilismi potilailla, joilla on vaikea insuliiniriippuvainen diabetes mellitus.
Aivolisäkkeen lyhytkasvuisuus tulisi erottaa somaattisesta fyysisen kehityksen viivästymisestä, joka johtuu kroonisista aineenvaihduntahäiriöistä (maksan, munuaisten, ruoansulatuskanavan sairauksissa), kroonisesta hypoksiasta (sydän- ja verisuoni- sekä hengityselinten sairauksissa, anemiassa); tuki- ja liikuntaelimistön systeemisistä sairauksista (kondrodystrofia, epätäydellinen osteogeneesi, eksostoosi) jne.
Toiminnallista (perustuslaillista) kasvun hidastumista havaitaan joskus myöhäisen murrosiän alkaessa näennäisen terveillä nuorilla; olemme havainneet, että se liittyy ensisijaisesti ohimenevään gonadotrooppisen aktiivisuuden vajaatoimintaan. Somatotrooppisen hormonin eritys ei yleensä heikenny tai on hieman vähentynyt. Gonadotropiinien stimulaatio voi kiihdyttää sekä seksuaalista kehitystä että kasvua.
Perheen luonteen lyhytkasvuisuutta tulisi pitää fysiologisen kehityksen varianttina.
Mitä on tutkittava?
Kuinka tarkastella?
Mitä testejä tarvitaan?
Kuka ottaa yhteyttä?
Hoito kääpiökasvuisuus
Lyhytkasvuisuuden hoito on pitkä prosessi. Tämä pakottaa lääkärin jakamaan kasvuun vaikuttavia keinoja ajan kuluessa saavuttaakseen suurimman kliinisen vaikutuksen noudattaen kahta perusperiaatetta:
- hoidon aiheuttaman kehityksen maksimaalinen lähentäminen fysiologisiin olosuhteisiin;
- säästäen epifyseaalisia kasvuvyöhykkeitä.
Monivuotinen kokemus lyhytkasvuisuuden hoidosta antaa meille mahdollisuuden pitää seuraavaa vaiheittaista hoitoa sopivana. Aikuispotilailla lyhytkasvuisuuden diagnoosi ei yleensä herätä epäilyksiä. Pienillä lapsilla, jos kliininen kuva on epäselvä, tarvitaan diagnostinen jakso: 6-12 kuukautta tarkkailussa ilman hormonikorvaushoitoa. Tänä aikana määrätään monimutkainen yleistä vahvistava hoito; riittävä ravitsemus, jossa lisätään eläinproteiinin, vihannesten ja hedelmien pitoisuutta ruokavaliossa, A- ja D-vitamiinit sekä kalsium- ja fosforivalmisteet. Riittävien muutosten puuttuminen kasvussa ja fyysisessä kehityksessä tätä taustaa vasten sekä hormonaalisten häiriöiden havaitseminen tutkimuksessa ovat perusta hormonihoidon aloittamiselle.
Aivolisäkkeen lyhytkasvuisuuden patogeneettisen hoidon pääasiallinen muoto on ihmisen kasvuhormonin käyttö, koska useimpien lyhytkasvuisuustapausten esiintyminen riippuu epäilemättä jostakin sen puutoksen muodosta. Tämän hormonin lajispesifisyyden vuoksi vain ihmisen ja kädellisen somatotropiini on tehokas ihmisille. Kliinisessä käytössä on laajalti lääkettä, joka on eristetty ei-tarttuviin ja ei-neoplastisiin sairauksiin kuolleiden ihmisten aivolisäkkeestä. Ihmisen somatotropiinia saadaan bakteerisynteesillä Escherichia coli -bakteerin avulla geenitekniikan avulla. Ihmisen somatotropiinia syntetisoidaan myös kemiallisesti, mutta se on erittäin kallista eikä sitä käytännössä käytetä kliinisessä käytössä. Somatotropiinihoitoon valitaan potilaat, joilla on todettu endogeenisen kasvuhormonin puutos, jonka luuston erilaistuminen ei ylitä 13–14-vuotiaille tyypillistä tasoa. Hoidolle ei ole ikärajoituksia.
Hoidon ensimmäisellä jaksolla käytettävät pienimmät tehokkaat annokset ovat 0,03–0,06 mg/kg ruumiinpainoa. Tehokkaimmat annokset ovat 2–4 mg kolme kertaa viikossa. Kerta-annoksen nostaminen 10 mg:aan ei johtanut riittävään kasvuvaikutuksen lisääntymiseen, mutta se aiheutti somatotropiinin vasta-aineiden nopeaa muodostumista.
Maassamme ihmisen kasvuhormonia on tutkittu vuodesta 1960 lähtien. Kahta hoito-ohjelmaa on testattu: jatkuvaa ja jaksottaista, joiden hoitojaksot ovat 2–3 kuukautta ja niiden välillä on samat välit. Potilaiden keskimääräinen pituuden kasvu ensimmäisen hoitovuoden aikana oli 9,52 ± 0,39 cm ja painonnousu 4,4 ± 0,14 kg. Pitkäaikaisessa jatkuvassa hoidossa keskimääräinen pituuden kasvu oli 0,82 cm/kk ja painonnousu 0,38 kg/kk; jaksottaisessa hoidossa 0,75 cm/kk ja 0,4 kg/kk. Jatkuva hoito tarjosi nopeamman pituuden kasvun, jonka vaikutus heikkeni jyrkästi 1–1,5 vuoden kuluttua. Jaksottaisessa hoidossa teho säilyi 3–4 vuotta, minkä ansiosta voimme pitää hoitojaksoa sopivampana. IGF-I:n (somatomediini C) tason määritys voi toimia luotettavana indikaattorina potilaan herkkyydestä somatotropiinihoidolle. IGF-I-pitoisuuden nousu somatotrooppisen hormonin käyttöönoton jälkeen mahdollistaa hoidon positiivisen vaikutuksen ennustamisen. Somatotropiinihoidon tärkeä etu on luuston luutumisen kiihtymättömyyden puuttuminen sen taustalla.
Tärkein keino lyhytkasvuisuuden hoidossa on anabolisten steroidien käyttö, jotka stimuloivat kasvua lisäämällä proteiinisynteesiä ja lisäämällä endogeenisen somatotrooppisen hormonin määrää. Hoitoa suoritetaan useiden vuosien ajan, ja jotkut lääkkeet korvataan vähitellen toisilla, vähemmän aktiivisista yhdisteistä aktiivisempiin. Anabolisten lääkkeiden vaihto on aiheellista, kun kasvuvaikutus vähenee 2-3 vuoden kuluttua, mikä johtaa kasvun lisäkasvuun. Hoito suoritetaan kuureina (lepoajan tulisi olla puolet hoitoajasta). Riippuvuuden sattuessa on myös aiheellista pitää pidempiä taukoja (jopa 4-6 kuukautta). Kerrallaan määrätään vain yksi anabolinen steroidi. Kahden tai useamman lääkkeen yhdistäminen ei ole tarkoituksenmukaista, koska se ei tehosta niiden aineenvaihduntaan ja kasvuun vaikuttavia vaikutuksia. Jälkimmäinen riippuu ensisijaisesti potilaiden iästä ja luuston erilaistumisasteesta hoidon alussa. Paras vaikutus havaitaan alle 16-18-vuotiailla potilailla, joiden luutuminen ei ylitä 14-vuotiaalle ominaista tasoa. Hoito on suositeltavaa aloittaa heti diagnoosin jälkeen, yleensä 5-7 vuoden iässä. Ennen hoitoa on vältettävä gonadotropiinien ja sukupuolihormonien määräämistä, jotka stimuloivat kasvua ja samalla kiihdyttävät luuston erilaistumista. Anabolisten steroidien annostelun periaate on pienimmistä tehokkaista annoksista vähitellen kasvaviin annoksiin. Yleisimpien lääkkeiden suositellut annokset ovat: neroboli (metandrostenoli, dianaboli) - 0,1–0,15 mg painokiloa kohden päivässä suun kautta; neroboliili (duraboli) - 1 mg painokiloa kohden kuukaudessa lihaksensisäisesti, kuukausiannos annetaan 2–3 annoksena 15 tai 10 päivän kuluttua; retaboliili (deka-duraboli) - 1 mg painokiloa kohden kerran kuukaudessa lihaksensisäisesti. Määriteltyjen annosten ylittäminen voi johtaa androgenisaatioon. Fysiologisina annoksina nämä yhdisteet eivät vaikuta merkittävästi sukupuolielinten tilaan eivätkä luuston erilaistumiseen, minkä ansiosta niitä voidaan käyttää pitkään molemmilla sukupuolilla olevilla potilailla. Tyttöjen tulisi olla gynekologin valvonnassa, koska yliannostuksen tai lisääntyneen yksilöllisen herkkyyden sattuessa joillakin potilailla voi kehittyä virilisaation merkkejä, jotka häviävät nopeasti hoidon lopettamisen jälkeen. Suun kautta otettavat lääkkeet, jotka on metyloitu 17. asemassa etyloituun muotoon, voivat joskus aiheuttaa kolestaattisen vaikutuksen, joten maksasairauksissa tulisi suosia parenteraalisia anabolisia yhdisteitä tai suun kautta otettavat lääkkeet tulisi yhdistää kolereettisiin aineisiin. Hyvin harvoin anabolisten steroidien käyttö voi aiheuttaa allergisia reaktioita (kutinaa, ihottumaa). Komplikaatioiden puuttuessa anabolisia steroideja käytetään niin kauan kuin kasvua edistävää vaikutusta havaitaan (jopa 16-18 vuoteen, ja joskus pidempään). Hoito suoritetaan yleisen vahvistavan hoidon taustalla.
Jos potilailla on kilpirauhasen vajaatoiminnan oireita, kilpirauhaslääkkeitä (tyroksiinia, tyreoidiinia, tyrotomia) määrätään samanaikaisesti yksilöllisesti valituissa annoksissa.
Poikien hoidossa seuraava vaihe on istukkahormonihoidon antaminen. Tätä lääkettä käytetään aikaisintaan 15–16-vuotiaana, ja usein vielä myöhemmällä iällä, Leydigin solujen stimuloimiseksi, mikä kiihdyttää sekä seksuaalista kehitystä että kasvua (omien androgeenien anabolisen aktiivisuuden vuoksi). Annoksia 1000–1500 IU käytetään 1–2 kertaa viikossa lihakseen 2 kuukauden kuureina, enintään 2–3 kertaa vuodessa. Jos vaikutus on epätäydellinen, istukkahormonihoitoa 16-vuotiailla ja sitä vanhemmilla pojilla vuorotellaan pienten androgeeniannosten (metyylitestosteroni annoksella 5–10 mg/vrk kielen alle) antamisen kanssa.
Yli 16-vuotiaat tytöt voivat aloittaa hoidon pienillä estrogeeniannoksilla, jotka simuloivat normaalia sukupuolisykliä. Hoitoa suoritetaan 3 viikon ajan joka kuukausi, minkä jälkeen pidetään tauko. Syklin toisessa vaiheessa, 3. viikosta alkaen, voidaan määrätä istukkahormonia gonadotropiinia annoksella 1000-1500 IU 3-5 kertaa viikossa tai lääkkeitä, joilla on gestageenivaikutus (pregniini, progesteroni).
Hoidon viimeinen vaihe (kasvuvyöhykkeiden sulkeutumisen jälkeen) on potilaan sukupuolta vastaavien sukupuolihormonien terapeuttisten annosten jatkuva anto sukupuolielinten, toissijaisten seksuaalisten ominaisuuksien täydelliseksi kehittämiseksi, libidon ja seksuaalisen potentiaalin varmistamiseksi. Yhdistetyt estrogeeni-progestiinivalmisteet (non-ovlon, bisekuriini, infekundiini, rigevidoni) sopivat naispotilaiden hoitoon ja pitkävaikutteiset androgeenivalmisteet (testenaatti, sustanon-250, omnadren-250) sopivat miespotilaiden hoitoon.
Yleistä vahvistavaa hoitoa suoritetaan (hoito, proteiini-kasvisruokavalio, vitamiinihoito, biostimulantit). Sinkkivalmisteiden käyttö on osoitettu, joiden vaikutusmekanismissa päärooli on IGF-1:n (insuliinin kaltainen kasvutekijä I) aktiivisuuden lisääminen.
Keskushermoston orgaanisten patologioiden yhteydessä annetaan tulehdusta estävää, imeytymistä estävää ja nestehukkaa lievittävää hoitoa. Kohdennettu systemaattinen hoito antaa rohkaisevan vaikutuksen. Pitkäaikaisen vaiheittaisen hoidon tuloksena 175:stä lyhytkasvuisesta potilaasta 148 (80,4%) onnistui saavuttamaan yli 130 cm:n pituuden, 92 (52,5%) yli 140 cm:n pituuden ja 32 (18,3%) 150–160 cm:n tai sitä suuremman pituuden. Samaan aikaan 37 potilasta (21,2%) kasvatti pituuttaan 30 cm, 107 (61,1%) 31–50 cm ja 31 (17,7%) 51–60 cm tai enemmän.
Ennuste
Ennuste riippuu lyhytkasvuisuuden muodosta. Geneettisissä lyhytkasvuisuustyypeissä elinikäinen ennuste on suotuisa. Aivolisäkkeen kasvaimen ja keskushermoston orgaanisen vaurion yhteydessä ennuste määräytyy pääasiallisen patologisen prosessin kehityksen dynamiikan mukaan. Nykyaikaiset hoitomenetelmät ovat merkittävästi lisänneet potilaiden fyysisiä kykyjä ja työkykyä sekä pidentäneet heidän elinajanodotettaan. Aktiivisen hoidon aikana potilaiden on käytävä lääkärintarkastuksessa 2–3 kuukauden välein ja ylläpitohoidossa 6–12 kuukauden välein.
Potilaiden sosiaalisen sopeutumisen kannalta ensiarvoisen tärkeää on työllistää heitä heidän älyllisten ja fyysisten kykyjensä mukaisesti.
On suositeltavaa valita ammatteja, jotka eivät liity raskaaseen fyysiseen rasitukseen, mutta antavat sinun osoittaa älyllisiä kykyjä, kykyä tehdä tarkkaa työtä ja kielitaitoa.


 [
[