Lääketieteen asiantuntija
Uudet julkaisut
Rabies lapsilla
Viimeksi tarkistettu: 04.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Rabies eli vesirokko on akuutti virustauti, joka tarttuu tartunnan saaneen eläimen puremasta, vahingoittaa hermostoa ja aiheuttaa vakavan enkefaliitin, joka johtaa kuolemaan.
Epidemiologia
Muinaisista ajoista lähtien kansanterveydellinen vitsaus on rabiesvirus, joka aiheuttaa nykyään noin 59 000 ihmisen kuoleman vuosittain, ja lähes kaikki kuolemat tarttuvat koiranpuremien välityksellä. Tällä on merkittävä taloudellinen vaikutus kehitysmaihin, erityisesti Afrikassa ja Aasiassa, jotka pystyvät kantamaan vähiten tällaisia tappioita. Lähes 100 %:n kuolleisuusasteestaan huolimatta koiran rabies on kuitenkin täysin ehkäistävissä oleva tauti, ja historialliset esimerkit koirien rabiesin hävittämisestä kehittyneissä maissa osoittavat tämän. [ 1 ]
Syyt raivotauti
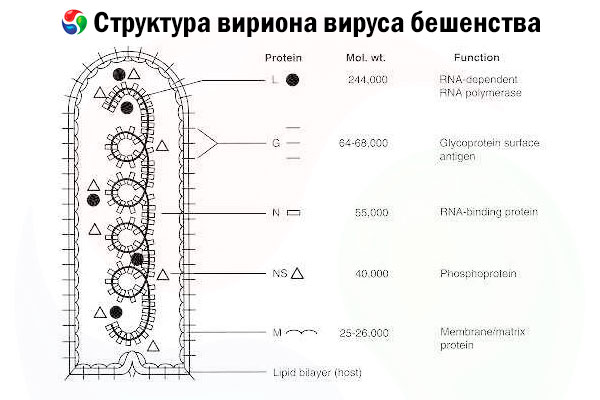
Taudinaiheuttaja on rabiesvirus (RV), joka on rabdovirusten heimoon kuuluva negatiivisen juosteen RNA-virus, jonka koko on noin 60 nm × 180 nm.
Se koostuu sisäisestä proteiiniytimestä eli nukleokapsidista, joka sisältää nukleiinihappoa, ja ulkokalvosta, lipidejä sisältävästä kaksoiskerroksesta, joka on peitetty transmembraanisilla glykoproteiinipiikeillä. Sillä on suhteellisen yksinkertainen modulaarinen genomirakenne ja se koodaa viittä rakenneproteiinia:
- RNA-riippuvainen RNA-polymeraasi (L),
- nukleoproteiini (N),
- fosforyloitu proteiini (P),
- matriisiproteiini (M) ja
- ulkopinnan glykoproteiini (G).
N-, P- ja L-proteiinit muodostavat yhdessä genomisen RNA:n kanssa ribonukleoproteiinikompleksin. G on ainoa RV-antigeeni, joka kykenee indusoimaan RV-neutraloivien vasta-aineiden tuotantoa, jotka ovat tärkeimmät immuunivasteen tekijät tappavaa RV-infektiota vastaan. Toisaalta ribonukleoproteiinikompleksin on osoitettu olevan tärkein RV-antigeeni, joka kykenee indusoimaan CD4+ T-soluja, jotka voivat tehostaa RV-neutraloivien vasta-aineiden tuotantoa rakenteellisen antigeenitunnistuksen kautta.[ 2 ] Ribonukleoproteiinikompleksilla voi olla tärkeä rooli immunologisen muistin ja pitkäaikaisen immuniteetin muodostumisessa.[ 3 ]
Luokittelu ja antigeenityypit
Lyssavirus-sukuun kuuluvat rabiesvirus sekä antigeenisesti ja geneettisesti sukua olevat rabiesvirukset: Lagosin, Mokolan ja Duvenhagen lepakkovirukset, sekä kaksi oletettua eurooppalaisten lepakkolyssavirusten alatyyppiä. Ristisuojaustutkimukset osoittavat, että perinteisillä rabiesrokotteilla immunisoidut eläimet eivät välttämättä ole täysin suojattuja, kun ne altistetaan muille lyssaviruksille.
Rabiesvirukset voidaan luokitella pysyviksi (adaptoituneet siirrostuksen kautta eläimissä tai soluviljelmissä) tai katuviruksiksi (villityyppi). Monoklonaalisten vasta-aineiden ja geneettisen sekvensoinnin käyttö katuviruksen erottamiseksi on auttanut tunnistamaan maailmanlaajuisesti tärkeimmistä isäntäreservuaareista peräisin olevia virusvariantteja ja ehdottamaan todennäköisiä ihmisen altistumislähteitä, kun potilaalla ei muuten ollut varmaa eläimen puremaa.[ 8 ]
Synnyssä
Villieläinten tärkein tartuntalähde ja -reservoiri ovat sudet, ketut, sakaalit ja lepakot, ja kotieläimistä koirat ja kissat, harvoin hevoset, naudat, siat, rotat jne. Tartunnan siirtyminen ihmisestä toiseen, vaikka se onkin mahdollista, on erittäin harvinaista. Tämä on tyypillinen zoonoottinen infektio. Ihmiset saavat rabiestartunnan pääasiassa koirista.
Kun sairas eläin puree ihmistä, virus lisääntyy puremakohdan lihaskudoksessa ja leviää sitten sensoristen ääreishermojen päihin saavuttaen motoneuronit. Viruksen leviämiseen ja aivojen vaurioitumiseen kuluva aika riippuu puremakohdasta. Pään ja kasvojen vakavissa puremissa virus voi saavuttaa keskushermoston 15–20 päivässä, ja vartalon ja raajojen ihon lievien vaurioiden ja siten pienen taudinaiheuttajaannoksen tapauksessa viruksen siirtyminen keskushermostoon voi viivästyä useita kuukausia tai jopa 1–1,5 vuotta. Keskushermostoon saavuttuaan virus kiinnittyy aivojen ja selkäytimen kudoksiin, pääasiassa medulla oblongatan, Ammonin sarven ja aivojen pohjan hermosoluihin. Selkäytimessä eniten vaurioituvat takasarvet. Keskushermostosta virus kulkeutuu hermorunkoja pitkin keskipakoisesti sylkirauhasiin, joissa se lisääntyy ja erittyy syljen mukana.
Rabieksen patogeneesin käsitteet
RV:llä on laaja isäntäkirjo ja se voi tartuttaa lähes kaikki nisäkkäät. Vaikka RV:n tartuntareittejä on raportoitu useita, luonnollinen tartunta tapahtuu yleisimmin pureman kautta. Puremien lisäksi RV-tartunnan saaneiden ruhojen syöminen voi edistää rabiesvirusinfektiota naalilla, ja RV:n kosketus limakalvojen kanssa on havaittu olevan toinen mahdollinen tartuntareitti.[ 9 ] Joissakin epätavallisissa olosuhteissa, kuten RV:n vahingossa tapahtuva vapautuminen aerosolina laboratoriossa tai RV:n aerosolina suurten lepakoiden asuttamissa luolissa,[ 10 ] voi esiintyä aerosolien siirtymistä.
Ei ole vielä selvää, replikoituvatko katu-RV:n ja hiireen vai kudosviljelyyn sopeutuneiden RV-kantojen ikääntymispaikalla ennen kuin ne pääsevät keskushermostoon. Vaikka nuorten hamsterien tai pesukarhujen kokeellinen lihaksensisäinen infektointi katu-RV:llä paljasti RV:n replikaation juovikaslihassoluissa ennen kuin virus tunkeutui motoristen hermosolujen aksoneihin hermo-lihasliitosten kautta,[ 11 ],[ 12 ] hiirten lihaksensisäinen infektointi hiireen sopeutuneella CVS-24 RV:llä osoitti, että RV siirtyy suoraan keskushermostoon ilman edeltävää replikaatiota rokotuspaikalla.[ 13 ] Kun RV on päässyt myeliinittomien aksonien päätteisiin, se kuljetetaan retrogradisesti soluun.
Viimeaikaiset löydökset viittaavat siihen, että aksonien vesikkelien kuljetus voi olla keskeinen strategia virionin pitkän matkan liikkeelle aksoneissa.[ 14 ] On arvioitu, että RV kulkeutuu aksonien sisällä nopeudella 3 mm/h.[ 15 ] Infektio leviää sitten synaptisten liitosten yhdistämien hermosolujen ketjussa. Tarkkaa mekanismia, joka edistää transsynaptista leviämistä, ei kuitenkaan vielä tunneta. Aivojen infektoinnin jälkeen virus leviää keskipakoisvoimalla perifeeriseen ja autonomiseen hermostoon monissa ääreishermoston elimissä.[ 16 ] Infektiokierron viimeisessä vaiheessa RV siirtyy sylkirauhasiin; replikaation jälkeen mukogeenisissa asinusoluissa se vapautuu sylkeen ja on valmis siirrettäväksi seuraavaan isäntään.[ 17 ]
Rabieksen aiheuttaman patologian osalta apoptoottista solukuolemaa on ehdotettu mahdolliseksi patogeeniseksi mekanismiksi kokeellisissa rabies-malleissa hiirillä, jotka on infektoitu tietyllä RV-kannalla.[ 18 ] Patogeeninen mekanismi, joka voi myötävaikuttaa rabiesille ominaiseen syvään keskushermoston toimintahäiriöön, voi olla heikentynyt hermosolujen toiminta. Geenien ilmentymisen on osoitettu olevan merkittävästi vähentynyt RV-tartunnan saaneissa neuroneissa, mikä johtaa proteiinisynteesin yleiseen heikkenemiseen,[ 19 ] ja useat tutkimukset ovat osoittaneet heikentynyttä hermovälitteistä signaalinsiirtoa RV-infektion jälkeen. Jiang osoitti, että asetyylikoliinireseptoriantagonistin sitoutuminen tartunnan saaneiden rottien aivohomogenaatteihin oli vähentynyt verrattuna kontrolliryhmään.[ 20 ] RV-tartunnan saaneiden rottien aivoissa havaittiin myös serotoniinin, unihäiriöiden, kivun havaitsemisen ja käyttäytymisen säätelyyn osallistuvan välittäjäaineen, vapautumisen ja sitoutumisen heikkenemistä.[ 21 ], [ 22 ] Neurovälitteiseen signaalinsiirtoon vaikuttamisen lisäksi oikean kammion infektio voi vaikuttaa myös ionikanaviin. Tartunnan saaneilla hiiren neuroblastoomasoluilla on jänniteherkkien natriumkanavien toiminnallisen ilmentymisen väheneminen, mikä voi estää aktiopotentiaalien muodostumista ja lopulta johtaa toimintahäiriöön.[ 23 ]
Vakavien patologisten leesioiden puuttumisen lisäksi keskushermostossa useimmat ihmisen rabiestapaukset eivät aiheuta immuunivastetta 7–10 päivää kliinisten oireiden alkamisen jälkeen. Näitä merkittäviä eroja rabiesin ja useimpien muiden virus- tai bakteeriperäisten keskushermostoinfektioiden patogeneesin välillä tukee edelleen se, että immunosuppressio on joko tehotonta tai haitallista rabiesin lopputulokselle.[ 24 ] Rabieksen uhreilla usein havaittu alhainen immuunivasteen taso on hämmentävä, koska sitä ei voida selittää RV-antigeenien heikolla immunogeenisyydellä. Itse asiassa RV:n G ja nukleokapsidiproteiini ovat tehokkaita B- ja T-solujen antigeenejä parenteraalisesti annettuna. [ 25 ] Mahdollinen selitys RV:n alhaiselle immuunivasteelle rabiesta sairastavilla ihmisillä tai eläimillä voi olla se, että RV-infektio keskushermostossa aiheuttaa immunosuppressiota, [ 26 ] ja on ehdotettu, että RV käyttää kumouksellista strategiaa, johon kuuluu apoptoosin estäminen ja tunkeutuvien T-solujen tuhoaminen. [ 27 ]
Heikennettyjen, ei-hermosoluihin sopeutuneiden RV-kantojen neuroinvasiivisuus eli kyky tunkeutua keskushermostoon perifeerisiltä alueilta eroavat merkittävästi patogeenisista katu-RV-kannoista neuroinvasiivisuutensa suhteen. Neuroinvasiivisuus viittaa niiden kykyyn tunkeutua keskushermostoon perifeerisiltä alueilta. Tässä suhteessa kudosviljelyyn sopeutuneilla RV-kannoilla joko ei ole tai on vain rajoitetusti kykyä tunkeutua keskushermostoon perifeerisiltä alueilta, kun taas katuviljelyyn tai hiireen sopeutuneet RV-kannat, kuten CVS-24, ovat erittäin invasiivisia.[ 28 ] Keskeisiä RV-neuroinvasioon liittyviä tekijöitä ovat viruksen sisäänotto, aksonaalinen kuljetus, transsynaptinen leviäminen ja viruksen replikaationopeus.
Vielä vähän aikaa sitten tietämyksemme RV:n patogeneesistä oli rajallista ja perustui pääasiassa kuvaileviin tutkimuksiin kaduilla esiintyvistä RV-kannoista tai kokeellisiin infektioihin laboratoriossa adaptoiduilla heikennetyillä kannoilla. Käänteisgenetiikan teknologian tulo on mahdollistanut RV:n patogeenisen fenotyypin määräävien viruselementtien tunnistamisen ja rabieksen patogeneesiin liittyvien mekanismien paremman ymmärtämisen.
Rabiesviruksen hankkimista, leviämistä ja replikaatiota säätelevien viruselementtien tunnistaminen
- Viruksen sieppaukseen osallistuvat viruselementit
RV-infektio alkaa viruksen kiinnittymisellä oletettuun solureseptoriin. Vaikka useita solukalvon pintamolekyylejä on ehdotettu RV-reseptoreiksi, mukaan lukien nikotiiniasetyylikoliinireseptori,[ 29 ] hermosolujen adheesiomolekyyli[ 30 ] ja matalan affiniteetin neurotrofiinireseptori p75 NTR,[31] on edelleen epäselvää, onko näillä molekyyleillä todellisuudessa roolia rabiesviruksen elinkaaressa. Tässä yhteydessä on äskettäin osoitettu, että RV G:n ja p75 NTR:n välinen vuorovaikutus ei ole välttämätön primaaristen hermosolujen RV-infektiolle.[ 32 ] Reseptoriin sitoutumisen jälkeen RV internalisoituu adsorptiivisen tai reseptorivälitteisen endosytoosin kautta.[ 33 ] Endosomien lokeron matala pH-ympäristö indusoi sitten RV G:ssä konformaatiomuutoksia, jotka laukaisevat viruskalvon fuusion endosomin kalvon kanssa, jolloin RNP vapautuu sytoplasmaan.[ 34 ] Viruksilla RV G:llä on ratkaiseva rooli viruksen sisäänotossa, todennäköisimmin vuorovaikutuksessa oletettujen solureseptorien kanssa, jotka helpottavat nopeaa sisäänottoa. Tässä suhteessa on osoitettu, että kudosviljelyyn sopeutuneiden RV-kantojen (esim. ERA, HEP ja CVS-11) patogeenisuus korreloi G-proteiinin antigeenisessä kohdassa III sijaitsevan determinantin läsnäolon kanssa. [ 35 ] Arg → Gln -mutaatio kohdassa 333 tässä ERA G -proteiinin antigeenisessä kohdassa johti seitsemänkertaiseen viiveeseen Gln333 RV-variantin internalisaatiossa verrattuna villityypin varianttiin. RV G:n Asn194→Lys194-mutaatio, joka selittää patogeenisen fenotyypin uudelleen ilmaantumisen, liittyi merkittävään internalisaatioajan lyhenemiseen.[ 36 ] Lisäksi kimeerisillä RV-virioneilla tehdyt kokeet osoittivat, että RV-virionien internalisaatioon tarvittava aika pidentyi merkittävästi ja patogeenisuus väheni voimakkaasti sen jälkeen, kun erittäin patogeenisen SB RV -kannan G-geeni, joka oli johdettu hopeasta peräisin olevan lepakkokannan RV-18 cDNA-kloonista,[ 37 ] korvattiin erittäin heikennetyn SN-kannan G-geenillä, joka eristettiin SAD B19 RV -rokotekannan cDNA-kloonista.[ 38 ] Yhdessä nämä tiedot tukevat käsitystä, että viruksen sisäänoton kinetiikka, joka on RV G:n funktio, on RV:n patogeenisyyden tärkeä määräävä tekijä.
- Virusten leviämiseen ja siirtymiseen liittyvät viruselementit
Rabieksen ainutlaatuinen ominaisuus on sen kyky levitä solusta toiseen. Havainto, että Gln333 ERA -variantti menettää pH-riippuvaisen solufuusioaktiivisuuden in vitro [ 39 ] ja sen kyky levitä solusta toiseen on huomattavasti heikentynyt [ 40 ], viittaa siihen, että RV G:llä on myös keskeinen rooli solusta toiseen leviämisessä ja siten viruksen siirtymisessä, todennäköisesti fusiogeenisen aktiivisuutensa kautta. Tätä mahdollisuutta tukee edelleen havainto, että patogeenisen RV-revertantin SPBNGAK:n leviämisnopeus on lähes kaksinkertainen ei-patogeeniseen SPBNGAK-varianttiin verrattuna. Mielenkiintoista on, että Asn 194 → Lys 194 -mutaatio G SPBNGAK:ssa aiheutti kalvofuusion pH-kynnyksen muutoksen korkeampaan pH-arvoon, mikä tukee hypoteesia, jonka mukaan korkeampi kalvofuusion pH-kynnys liittyy lisääntyneeseen viruksen leviämiseen. [ 41 ]
Rotilla [ 42 ] ja reesusapinoilla [ 43 ] tehdyt RV-infektion transneuronaalisten indikaattoreiden tutkimukset ovat osoittaneet, että rabiesvirus kulkeutuu yksinomaan retrogradiseen suuntaan aksoneissa. Vaikka useat RV-proteiinit osallistuvat hermosolujen kuljetusmekanismeihin, RV G:llä näyttää olevan hallitseva rooli RV-infektion transneuronaalisessa leviämisessä. Esimerkiksi vaikka hevosen tarttuvan anemiaviruksen (EIAV) perifeerinen infektio, joka on pseudotyypitetty RV G:llä, johtaa viruksen siirtymiseen selkäytimeen, sama EIAV, joka on pseudotyypitetty vesikulaarisen stomatiittiviruksen G:llä, ei päässyt hermostoon. [ 44 ] Lisäksi ERA G Arg 333 → Gln 333 -mutantin viruksen leviämisen keskushermostossa havaittiin olevan voimakkaasti vähentynyt verrattuna villityypin mutanttiin, mikä viittaa edelleen ehjän RV G:n rooliin transsynaptisessa leviämisessä. Vakuuttavin todiste RV G:n tärkeästä roolista transsynaptisessa kuljetuksessa tulee kuitenkin hiirten kallonsisäisestä infektiosta rekombinantilla G-puutteellisella RV-viruksella, mikä osoitti, että infektio rajoittui inokulaatiokohdan neuroneihin ilman merkkejä leviämisestä sekundaarisiin neuroneihin.[ 45 ] On kuitenkin todennäköistä, että RV G:n lisäksi myös RV M:llä on rooli viruksen leviämisessä ja siten transsynaptisessa kuljetuksessa. Tässä suhteessa osoitettiin, että kimeerisen SN-BMBG RV-variantin, joka sisältää sekä M:n että G:n erittäin patogeenisesta SB:stä, leviäminen oli merkittävästi suurempaa kuin kimeerisen SN-BG- tai SN-BM-variantin leviäminen, jotka sisältävät vastaavasti G:n ja M:n SB:stä. Tämä viittaa siihen, että M:n ja G:n optimaalinen vuorovaikutus voi olla tärkeässä roolissa solusta soluun tapahtuvassa viruksen leviämisessä. [ 46 ] Koska RV M tukee viruksen kuroutumista, [ 47 ] on todennäköistä, että kimeerisen RV SN-BMBG -variantin tehokkaampi leviäminen johtuu optimaalisesta viruksen kuroutumisesta postsynaptisessa kalvossa.
Viimeaikaiset tutkimukset ovat osoittaneet, että RV P:n ja dyneiinin kevytketjun välinen vuorovaikutus yhdistää RV:n RNP:n isäntäsolun kuljetusjärjestelmään, mikä helpottaa viruksen retrogradista aksonaalista kuljetusta.[ 48 ],[ 49 ] Aikuisten hiirten perifeerinen infektio kuitenkin osoitti, että RV P:n LC8:aa sitovan domeenin deleetio ei estä viruksen pääsyä keskushermostoon, mikä viittaa siihen, että RV-proteiini ei ole suoraan osallisena RV:n retrogradisessa aksonaalisessa leviämisessä.[ 50 ]
- Viruksen replikaatiota säätelevät viruselementit
Toisin kuin monet muut virukset, kuten influenssavirus, RV:n patogeenisuus on kääntäen verrannollinen viruksen RNA:n synteesin nopeuteen ja tarttuvien viruspartikkelien tuotantoon. Eri kimeeristen virusten tuottamien virus-mRNA:n ja genomisen RNA:n tasojen vertailu viittaa siihen, että viruksen RNA:n transkriptiota ja replikaatiota säätelevät useat tekijät, mukaan lukien RV M, joka on tunnistettu transaktioon vaikuttavaksi tekijäksi, joka välittää siirtymistä alkuperäisestä korkeasta mRNA:n synteesin tasosta genomisen RNA:n synteesiin.[ 51 ] Lisäksi kaikkien rabdovirusten M pystyy sulkemaan virusgeenien ilmentymisen sitoutumalla RNP:hen, mikä johtaa erittäin tiivistetyn, runkomaisen rakenteen muodostumiseen, joka ei pysty tukemaan RNA-synteesiä.
Jotta voitaisiin tunnistaa muita viruksen elementtejä, jotka kontrolloivat patogeenisuutta säätelemällä viruksen replikaatiota, erittäin patogeenisen SB-kannan 5'-terminaaliset sekvenssit korvattiin vaiheittain erittäin heikennetyn SN-rokotekannan sekvensseillä, jolloin saatiin rekombinanttivirukset SB2 (terminaalinen sekvenssi [TS] + L), SB3 (TS + L + pseudogeeni [Ψ]), SB4 (TS + L + Ψ + G) ja SB5 (TS + L + Ψ + G + M). Lihaksensisäinen infektio emoviruksilla SB- ja SN-viruksilla sekä kimeerisillä RV-viruksilla SB2, SB3, SB4 ja SB5 aiheutti korkeimman kuolleisuuden SB-tartunnan saaneilla hiirillä, mutta ei sairastuvuutta tai kuolleisuutta SN-tartunnan saaneilla hiirillä. TS:n, L:n ja SB:n korvaaminen vastaavilla SN-elementeillä johti sairastuvuuden ja kuolleisuuden lievään vähenemiseen, ja ylimääräinen G- tai G- ja M-vaihto vähensi voimakkaasti tai poisti kokonaan viruksen patogeenisyyden.
Näiden villityypin ja kimeeristen RV-virusten fenotyyppinen karakterisointi kudosviljelmässä paljasti, että tietyn RV:n patogeenisuus korreloi käänteisesti sen kykyyn replikoitua hermosoluissa. Vaikka SB replikoitui lähes 1000 kertaa SN:ää alhaisemmilla tasoilla, ja TS:n, L:n ja SB:ssä olevien geenien korvaaminen SN-tasoilla vaikutti vain vähän viruksen kasvukinetiikkaan, SB:n G:n tai G:n ja M:n korvaaminen vastaavilla SN-geeneillä johti virustuotannon 1 log-yksikön kasvuun, mikä viittaa siihen, että viruksen RNA:n replikaatiokinetiikkaa sekä viruspartikkelien tuotantoa säätelee suurelta osin RV G -proteiini. Tätä johtopäätöstä tukevat tiedot, jotka on saatu RV G -varianteista, jotka eroavat toisistaan yhden aminohapon osalta G-proteiineissaan. Patogeeninen rabiesvirusvariantti SPBNGAK 194 tuotti NA-soluissa virustiitterin, joka oli 1 logaritmin verran alhaisempi kuin ei-patogeenisen variantin SPBNGAN 194 tuottama, ja reaaliaikainen PCR-analyysi osoitti, että viruksen RNA:n transkriptio- ja replikaationopeudet SPBNGAK-tartunnan saaneissa NA-soluissa olivat 5 ja 10 kertaa korkeammat kuin SPBNGAK-tartunnan saaneissa NA-soluissa.[ 52 ] Lisätodisteita patogeenisyyden ja virus-RNA:n synteesin ja viruspartikkelien tuotannon nopeuden välisestä käänteisestä korrelaatiosta saatiin hiirillä, jotka oli infektoitu kimeerisillä rekombinanttiviruksilla, joissa heikennetyn SN-kannan G- ja M-geenit oli korvattu erittäin patogeenisen SB-kannan vastaavilla. Nämä kokeet osoittivat RV G:tä kantavan emokannan SN-kannan patogeenisyyden merkittävän kasvun patogeeniseen SB-kantaan verrattuna. Patogeenisuus lisääntyi entisestään, kun sekä G että M SB:stä lisättiin SN:ään.
G:n tai M:n tai molempien korvautuminen SN:ssä vastaavilla geeneillä SB:stä liittyi merkittävään viruspartikkelien tuotantonopeuden sekä viruksen RNA:n synteesinopeuden laskuun. Nämä tiedot osoittavat, että sekä G:llä että M:llä on tärkeä rooli RV:n patogeneesissä säätelemällä viruksen replikaatiota. Löydös, että G:n tai G:n ja M:n korvaaminen SN:ssä SB:n G:llä tai G:llä ja M:llä johtaa viruksen RNA:n transkription ja replikaation kohtalaiseen tai voimakkaaseen vähenemiseen, kun taas pelkän M:n korvaaminen SN:ssä SB:n M:llä johtaa viruksen RNA:n transkription ja replikaation voimakkaaseen lisääntymiseen, osoittaa, että RV G:llä on myös tärkeä säätelytehtävä viruksen RNA:n transkriptiossa/replikaatiossa joko yksinään tai vuorovaikutuksessa M-proteiinin kanssa. Mekanismi, jolla RV G -geeni kontrolloi viruksen RNA:n synteesiä, on tuntematon. Tietyt RV G -geenien nukleotidisekvenssit, kuten Arg333:n ja Lys 194:n kodonit sisältävät sekvenssit, on tunnistettu solujen miRNA:iden kohteiksi. On osoitettu, että solujen miRNA:iden suorittama kohteen tunnistus voi johtaa viruksen replikaation positiiviseen tai negatiiviseen säätelyyn. [ 53 ] RV G -geenisekvenssin sisällä tapahtuvat Arg 333 → Glu 333 tai Lys 194 → Ser 194 -substituutiot johtavat miRNA-kohdesekvenssien häviämiseen, mikä puolestaan liittyy viruksen RNA-synteesin merkittävään kasvuun [Faber M, Thomas Jefferson University, PA, USA, julkaisematon data], mikä viittaa siihen, että isäntäsolujen miRNA:illa on myös tärkeä rooli RV-replikaation säätelyssä, kuten on osoitettu muilla RNA-viruksilla, mukaan lukien vesikulaarinen stomatiittivirus ja HCV. [ 54 ], [ 55 ]
Viruksen replikaation säätely näyttää olevan yksi tärkeimmistä RV-patogeneesiin liittyvistä mekanismeista. Välttääkseen immuunivasteen ja säilyttääkseen hermosoluverkoston eheyden, patogeeniset RV-kannat, mutta eivät heikennetyt kannat, voivat säädellä kasvunopeuttaan. Alhaisempi replikaationopeus todennäköisesti hyödyttää patogeenisia RV-kantoja säilyttämällä hermosolurakenteen, jota nämä virukset käyttävät keskushermostoon pääsemiseen. Toinen selitys patogeenisten RV-kantojen alhaisemmalle replikaationopeudelle on se, että välttääkseen isännän immuunijärjestelmän varhaisen havaitsemisen, virus ylläpitää antigeeniensä ilmentymistä minimaalisilla tasoilla.
RV G:n ilmentymisen, apoptoosin ja patogeenisyyden välinen suhde
On hyvin tunnettua, että katuraapeviruskannat, jotka ovat merkittävästi patogeenisempiä kuin kudosviljelyyn sopeutuneet kannat, ilmentävät hyvin rajoitettuja G-tasoja eivätkä indusoi apoptoosia ennen kuin infektiosyklin loppuvaiheessa. Tämä viittaa siihen, että tietyn viruskannan patogeenisuus on käänteisessä korrelaatiossa RV G:n ilmentymisen ja kyvyn indusoida apoptoosia kanssa.[ 56 ] Suoraa näyttöä G:n ilmentymisen tason ja apoptoosin laajuuden välisestä korrelaatiosta saatiin rekombinantti-RV SPBNGA-GA:lla, jolla oli kaksi identtistä G-geeniä ja joka yliekspressoi RV G:tä.[ 57 ] Tällä rekombinantti-RV:llä infektoitujen hermosoluviljelmien morfologiset tutkimukset osoittivat, että solukuolema lisääntyi merkittävästi RV G:n yliekspression rinnalla ja että apoptoosi on tärkein mekanismi, joka liittyy RV G:n välittämään kuolemaan. Erityisesti F-aktiinin värjäytymisen väheneminen SPBNGA-GA-infektion jälkeen on yhdenmukainen apoptoosin indusoiman aktiinifilamenttien depolymeroitumisen kanssa. Lisäksi TUNEL-positiivisten tumien määrä SPBNGA-GA-tartunnan saaneissa neuroneissa lisääntyi merkittävästi verrattuna tartuttamattomiin ja SPBNGA-tartunnan saaneisiin neuroneihin. Mekanismi, jolla RV G -geeni välittää apoptoosin signalointiprosessia, on kuitenkin edelleen pitkälti tuntematon. On ehdotettu, että tietyn kynnyksen ylittävä RV G:n ilmentyminen häiritsee vakavasti solukalvoa. On erittäin todennäköistä, että apoptoosisolut eivät poistu nopeasti keskushermostosta ja siksi ne käyvät läpi sekundaarisen nekroosin. [ 58 ] Toisaalta RV-infektio ja erityisesti RV G -proteiinin liikailmentyminen voivat johtaa pyroptoosiin, apoptoosin kaltaiseen solukuolemareittiin, joka, toisin kuin apoptoosi, sisältää kaspaasi 1:n aktivaation ja johtaa siten nekroosiin. [ 59 ] RV-infektion aiheuttaman nekroosin tai pyroptoosin asteella on todennäköisesti ratkaiseva rooli antiviraalisen immuniteetin induktiossa. Vaikka apoptoosisolut säilyttävät kalvonsa eheyden eivätkä stimuloi synnynnäistä immuunivastetta, nekroottiset solut läpäisevät ja erittävät endogeenisiä adjuvantteja, jotka voivat laukaista voimakkaan synnynnäisen immuunivasteen. [ 60 ]
Koska apoptoosin/nekroosin taso korreloi RV-immunogeenisyyden kanssa, on ehdotettu, että apoptoottisten/nekroottisten solujen immunostimulatorinen vaikutus todennäköisimmin edistää suojaavan immuunivasteen syntymistä. Siksi RV-G:n ilmentymisen säätely on hyvin todennäköisesti tärkeä tekijä rabies-taudin patogeneesissä, koska se tarjoaa keinon patogeenisten RV-varianttien selviytymiselle ja leviämiselle hermostossa aiheuttamatta ilmeistä hermosoluvauriota ja herättämättä suojaavaa immuunivastetta, joka estäisi infektion.
RV G:n ilmentymistä voidaan säädellä RNA-synteesin tasolla, translaation jälkeisellä tasolla tai molemmilla. Eri RV-kimeeristen varianttien ilmentämien RV G -tasojen on osoitettu heijastuvan viruksen RNA-synteesinopeudessa, mikä viittaa siihen, että näiden varianttien RV G:n ilmentymisen erilainen säätely johtuu viruksen mRNA:n transkriptionopeuden vaihteluista. Kuten viruksen RNA:n transkriptioidenkin kohdalla, näiden varianttien ilmentämän RV G:n määrä korreloi käänteisesti viruksen patogeenisyyden kanssa. Toisaalta primaaristen hermosoluviljelmien infektointi vähemmän patogeenisella RV-variantilla CVS-B2c johti nelinkertaisesti korkeampiin G-proteiinitasoihin kuin infektio erittäin patogeenisella CVS-N2c-variantilla, vaikka G mRNA:n synteesitasot olivat molemmissa infektioissa vertailukelpoisia. Pulse-chase-kokeet osoittivat, että korkeammat G-proteiinitasot CVS-B2c-tartunnan saaneissa neuroneissa johtuivat suurelta osin CVS-B2c G -proteiinin hitaammasta hajoamisnopeudesta verrattuna CVS-N2c G -proteiiniin. Mekanismi, joka johtaa CVS-N2c G -proteiinin nopeampaan proteolyyttiseen hajoamiseen, on kuitenkin vielä selvittämättä.
Oireet raivotauti
Rabieksen itämisaika on keskimäärin 30–90 päivää. Massiivisen pään ja kasvojen laajojen haavojen kautta tapahtuvan tartunnan tapauksessa itämisaika voi lyhentyä 12 päivään. Harvinaisissa tapauksissa itämisaika voi kestää vuoden tai kauemmin.
Taudin kolme jaksoa muuttuvat tiukasti peräkkäin: prodromaalinen, herätevaihe ja halvaus.
Prodromaalinen vaihe alkaa puremakohdan särkevällä tai venyttävällä kivulla sekä hermojen suuntaisella kivulla. Arven alueella voi esiintyä polttavaa tunnetta, kutinaa, joskus punoitusta ja turvotusta. Potilaalla esiintyy yleistä huonovointisuutta, päänsärkyä ja pahoinvointia. Oksentelua, ruumiinlämmön nousua 37,5–38 °C:een ja etenevän mielenterveyshäiriön oireita: lisääntynyttä refleksiärtyneisyyttä, selittämätöntä ahdistuksen, pelon ja melankolian tunnetta. Usein potilas on masentunut, estäytynyt, vetäytyvä, kieltäytyy syömästä, nukkuu huonosti, valittaa synkistä ajatuksista ja pelottavista unista. Prodromaalinen vaihe kestää 2–3 päivää, joskus jopa 7 päivään. Tämän jakson lopussa voi esiintyä ahdistuskohtauksia, joihin liittyy lyhytaikaisia hengitysvaikeuksia, rintakehän kireyttä, johon liittyy takykardiaa ja hengitystiheyden nousua.
Jännitysjaksolle on ominaista vesikammoisuuden ilmaantuminen: juoda yritettäessä ja sitten veden näkemisestä tai sen muistuttamisesta potilas kokee nielun ja kurkunpään kouristuksen, jonka aikana hän heittää vesimukin pois huutaen, heittää vapisevat kädet eteenpäin, heittää päänsä ja vartalonsa taaksepäin. Niska on venytetty, kivulias irvistys vääristää kasvoja, jotka muuttuvat sinertäviksi hengityslihasten kouristuksen vuoksi. Silmät pullistuvat, ilmaisevat pelkoa, anelevat apua, pupillit laajenevat, hengittäminen on vaikeaa. Kohtauksen huipulla sydän- ja hengityspysähdys on mahdollinen. Kohtaus kestää useita sekunteja, minkä jälkeen potilaan tila näyttää paranevan. Myöhemmin kurkunpään ja nielun lihasten kouristuksia voi esiintyä jopa ilman liikkeestä (aerofobia), kirkkaasta valosta (valonarkuus) tai kovasta sanasta (akustofobia). Kohtauksiin liittyy psykomotorista agitaatiota, jonka aikana potilas käyttäytyy kuin "hullu". Tajunta on samea kohtauksen aikana, mutta kirkastuu kohtausten välisenä aikana. Kiihtyneisyyden aikana sympaattisen hermoston lisääntyneen sävyn vuoksi potilailla esiintyy jyrkkää syljenerityksen lisääntymistä (sialorrea), eikä sylkeä voida niellä nielun lihasten kouristuksen vuoksi. Potilas suihkuttaa sylkeä. Joillakin potilailla voi kehittyä meningismin ja jopa opistotonuksen merkkejä, ja kouristukset ovat yleisiä. Tässä tapauksessa aivo-selkäydinneste ei välttämättä muutu, mutta joillakin potilailla proteiinipitoisuus voi nousta ja solujen määrä voi lisääntyä lymfosyyttien vuoksi.
Ilman riittävää hoitoa nestehukan merkit lisääntyvät, kasvonpiirteet terävöityvät ja paino laskee. Ruumiinlämpö nousee korkeiksi. Kouristukset ovat mahdollisia. Viritysvaiheen kesto on noin 2–3 päivää, harvoin 4–5 päivää. Kuolemaan johtava lopputulos tapahtuu yleensä yhden kohtauksen aikana. Harvoin potilas selviää taudin kolmanteen vaiheeseen asti.
Halvauksen aikana potilas rauhoittuu. Hydrofobiakohtaukset loppuvat, potilas voi juoda ja niellä ruokaa, tajunta on kirkas. Näennäisestä hyvinvoinnista huolimatta letargia, apatia ja masennus lisääntyvät pian, raajojen halvaantuminen, lantion alueen häiriöt ja aivohermojen halvaantuminen ilmaantuvat pian. Ruumiinlämpötila nousee 42–43 °C:een, valtimopaine laskee, ja ensimmäisen päivän loppuun mennessä kuolema tapahtuu sydän- ja verisuoni- sekä hengityskeskusten halvaantumiseen.
Perifeerisessä veressä havaitaan neutrofiilistä leukosytoosia, kohonnutta hemoglobiinia, punasoluja ja hematokriittiä.
Mikä häiritsee sinua?
Lomakkeet
Kliinisesti erotetaan tyypilliset ja epätyypilliset muodot. Epätyypillisiin muotoihin kuuluvat kaikki tapaukset, joissa ei ole kiihottumista eikä vesikauhua. Epätyypillisiä muotoja ovat bulbaarinen, pikkuaivo, meningoenkefaliittinen jne.
Diagnostiikka raivotauti
Rabieksen diagnosointi onnistuu rabies-antigeenin, vasta-aineiden, virus-RNA:n tai viruseristyksen avulla. Koska mikä tahansa yksittäinen testi voi olla negatiivinen rabies-potilaalla, joskus tarvitaan seeruminäytteitä rabies-vasta-aineiden havaitsemiseksi, sylkinäytteitä virusviljelyä varten ja ihobiopsiaa virusantigeenin suoraa immunofluoresenssitestiä varten, erityisesti silloin, kun rabies-epäily on vahva.
Yksi nopeimmista menetelmistä ante mortem -rabieksen diagnosoimiseksi ihmisillä on suorittaa suora immunofluoresenssitesti niskasta otetusta ihobiopsiasta rabies-antigeenin havaitsemiseksi. Suora immunofluoresenssitesti on herkin ja spesifisin menetelmä rabies-antigeenin havaitsemiseksi ihosta ja muista tuoreista kudoksista (esim. aivobiopsiasta), vaikka tulokset voivat joskus olla negatiivisia taudin alkuvaiheessa. Jos tuoretta kudosta ei ole saatavilla, fiksoitujen kudosten entsymaattinen pilkkominen voi lisätä immunofluoresenssitestin reaktiivisuutta; herkkyys voi kuitenkin olla kohtuuttoman alhainen.
Diagnoosi voidaan tehdä myös eristämällä virus syljestä neuroblastoomasolujen tai laboratoriojyrsijöiden rokottamisen jälkeen; tämä on yleensä tehokkainta sairauden ensimmäisten 2–3 viikon aikana. Myös rabiesvirusta neutraloivien vasta-aineiden osoittaminen rokottamattomien henkilöiden seerumista, joka yleensä suoritetaan nopealla fluoresoivan fokuksen estotestillä (RFFIT), on diagnostista. Vasta-aineiden esiintyminen aivo-selkäydinnesteessä vahvistaa diagnoosin, mutta ne voivat ilmetä 2–3 päivää myöhemmin kuin seerumin vasta-aineet, ja siksi ne voivat olla vähemmän hyödyllisiä taudin alkuvaiheissa. Vaikka rokotuksen jälkeinen serologinen vaste on yleensä erottamaton taudin aiheuttamasta serologisesta vasteesta, rokotus ei yleensä tuota vasta-aineita aivo-selkäydinnesteelle.
Vain seitsemän rabies "toipumistapausta" viimeisten 25 vuoden aikana on dokumentoitu hyvin. Vaikka rabiesvirusta ei eristetty keneltäkään potilaalta, seeruminäytteiden korkeat rabiesta neutraloivien vasta-aineiden pitoisuudet ja neutraloivien vasta-aineiden esiintyminen aivo-selkäydinnesteessä tukivat diagnoosia vahvasti.
Mitä on tutkittava?
Mitä testejä tarvitaan?
Differentiaalinen diagnoosi
Ihmisen rabieksen diagnoosi tehdään yleensä epidemiologisten ja kliinisten tietojen perusteella ja vahvistetaan laboratoriossa. Diagnoosi on yksinkertainen, jos potilaalla on ollut aiemmin eläinten puremia ja kaikki oireet ja löydökset ovat ilmenneet. Muussa tapauksessa on tarpeen arvioida nopeasti mutta huolellisesti vähemmän tyypillisten tapausten epidemiologiset ja kliiniset ominaisuudet ennen tiettyjen laboratoriokokeiden suorittamista. Kaikilta potilailta, joilla on neurologisia löydöksiä tai oireita tai selittämätöntä enkefaliittia, tulisi kysyä mahdollisuudesta altistua eläimille rabieksen endeemisillä alueilla asuinmaassa tai sen ulkopuolella. Rabieksen epäily useissa Yhdysvalloissa viime aikoina tapahtuneissa ihmiskuolemissa on saattanut johtua altistumisen huolellisen historian puutteesta.
Taudin puhkeaessa rabies voi jäljitellä monia tarttuvia ja ei-tarttuvia tauteja. Monet muut enkefaliitit, kuten herpesvirusten ja arbovirusten aiheuttamat, muistuttavat rabiesta. Myös muut tartuntataudit voivat jäljitellä rabiesta, kuten tetanus, aivomalaria, riketsioosi ja lavantauti. Rabiekseen sekoitettavissa olevia halvaantumistartuntatauteja ovat polio, botulismi ja herpes simian B -enkefaliitti.
Ei-tarttuvia tauteja, jotka voidaan sekoittaa rabiekseen, ovat useat neurologiset oireyhtymät, erityisesti akuutti tulehduksellinen polyneuropatia (Guillain-Barrén oireyhtymä), sekä allerginen rokotuksen jälkeinen enkefalomyeliitti, joka johtuu rabiesrokotuksesta hermokudoksessa, myrkytyksestä tai lääkeainepäihtymyksestä, alkoholin vieroitusoireista, akuutista porfyriasta ja rabieshysteriasta. Guillain-Barrén oireyhtymä voidaan sekoittaa halvaantuneeseen rabiekseen ja päinvastoin.
Kuka ottaa yhteyttä?
Hoito raivotauti
Rabieksen hoitoa ei ole kehitetty. Suurten annosten antaminen spesifisille rabiesvastaisille immunoglobuliinille ja leukosyytti-interferonille on tehotonta. Oireenmukaista hoitoa annetaan potilaan kärsimysten lievittämiseksi. Tätä varten potilas sijoitetaan erilliseen osastolle tai lokeroon, ja hänelle luodaan suojajärjestelmä, joka rajoittaa ulkoisen ympäristön vaikutusta (vähennetty melu, kirkas valo, ilmavirtaus). Keskushermoston herkkyyden vähentämiseksi määrätään unilääkkeitä, kouristuslääkkeitä ja kipulääkkeitä. Nestetasapaino normalisoidaan.
Halvaantumisvaiheessa määrätään lääkkeitä, jotka stimuloivat sydän- ja verisuoni- sekä hengityselinten toimintaa. On suositeltavaa käyttää hyperbaarista hapetusta, aivojen hypotermiaa ja kontrolloitua mekaanista hengitystä potilaan täydellisen kurarisoinnin yhteydessä. Kaikki hoitomenetelmät ovat kuitenkin käytännössä tehottomia. Parhaassa tapauksessa potilaan elämää on mahdollista pidentää useilla kuukausilla. Epäsuotuisan lopputuloksen määrää aivorungon vaurion vakavuus ja elintärkeiden keskusten tuhoutuminen.
Ennaltaehkäisy
Pasteurin kehittämä ensimmäinen rabiesrokote vuonna 1885 aloitti paljon tehokkaamman rabiestorjunnan aikakauden. Nykyään, vaikka rabieskuolleisuus ihmisillä on lähes 100 %, tauti on täysin ehkäistävissä rokotuksilla ennen altistusta ja/tai altistuksen jälkeen. Pasteur ja hänen kollegansa aloittivat yksityisten koirien rokottamisen Pariisissa, mutta ensimmäinen koirien massarokotus suoritettiin 1920-luvun alussa Japanissa, mikä oli ensimmäinen merkittävä kansallinen rabiestorjuntaohjelma. Villieläinten suun kautta otettavan rokotuksen, joka kehitettiin ensimmäisen kerran 1970-luvulla, on sittemmin toistuvasti osoitettu torjuvan tehokkaasti tautia tärkeimmillä maalla elävillä isännillä, kuten ketuilla, pesukarhuilla ja haisunäädillä.[ 68 ] Jatkuva rabiesrokotus säiliöeläinpopulaatioissa 70 %:n tai korkeammalla kattavuudella lopulta poistaa RABV:n säiliölajeista ja estää viruksen leviämisen satunnaisiin isäntiin.[ 69 ]
Fylogeneettiset tiedot osoittavat, että lyssavirukset tartuttivat lepakoita kauan ennen kuin ne tartuttivat maanisäkkäitä, ja useimmat lyssavirukset, mukaan lukien RABV, leviävät edelleen useissa lepakkolajeissa maailmanlaajuisesti.[ 70 ] Tehokkaita menetelmiä RABV:n leviämisen estämiseksi lepakoiden välillä ei kuitenkaan ole vielä löydetty, mikä sulkee pois mahdollisuuden täydelliseen rabiesten hävittämiseen tällä hetkellä. Kuitenkin, jopa altistumisen jälkeen RABV:lle rabies-tartunnan saaneen nisäkkään pureman kautta, turvallinen ja tehokas altistuksen jälkeinen estohoito (PEP, mukaan lukien haavan puhdistus, rabies-immunoglobuliini ja rabiesrokotus) voi suojata ihmisiä rabiestartunnalta, jos hoito annetaan viipymättä ja Maailman terveysjärjestön (WHO) suositusten mukaisesti.
Nämä kaksi ihmiskuolemien ehkäisymenetelmää – toinen perustuu altistuneiden ihmisten rokottamiseen ja toinen riittävän määrän koirien rokottamiseen tartuntakierteen katkaisemiseksi lähteellä – ovat "yhden terveyden" kulmakiviä koirien raivotaudin ehkäisyssä ja torjunnassa. Näitä kahta erilaista ihmiskuolemien ehkäisykeinoa tarkasteltiin erillisinä vaihtoehtoina: strategia A, joka perustuu PEP-toimenpiteiden tarjoamiseen ihmisille, ja strategia B, joka perustuu koirien rokottamiseen; tai osina yhdistettyä strategiaa A + B vaihtoehtoisten strategioiden todennäköisten kustannusten analyysissä.[ 71 ]
Maat, kuten Thaimaa, ovat onnistuneet valtavasti ehkäisemään ihmiskuolemia PEP:n avulla, mutta ne ovat myös havainneet kasvavaa kysyntää ja siihen liittyviä kustannuksia, jotka liittyvät pelkästään PEP:n käyttöön. [ 72 ] Esimerkiksi vuonna 2003 PEP:iä tarvitsi neljä kertaa enemmän ihmisiä (yli 400 000) kuin vuonna 1991. Tuoreet tiedot osoittavat, että Kiinan kansantasavalta, joka rokottaa 15 miljoonaa ihmistä vuodessa mahdollisen raivotautialtistuksen jälkeen, käyttää noin 650 miljoonaa Yhdysvaltain dollaria vuodessa pelkästään PEP:iin. [ 73 ]
Paljon kestävämpi lähestymistapa on estää tartunnan leviäminen sen lähteellä eli eläinpopulaatiossa ja samalla parantaa altistuneiden ihmispotilaiden pääsyä PEP-hoitoon tarvittaessa. Kun koiran raivotaudin torjuntaan on poliittista tahtoa ja riittävästi rahoitusta, kuolemantapaukset voidaan ja on jo poistettu. Koirien rokotusten laaja käyttö on johtanut koiran raivotaudin hävittämiseen useissa maissa, mukaan lukien Malesiassa vuonna 1954 [ 74 ], Japanissa vuonna 1956, Taiwanissa vuonna 1961, Singaporessa ja erityisesti koko Länsi-Euroopassa (katsaus Rupprecht et al., King et al. ja Gongal ja Wright). [ 75 ]
Использованная литература


 [
[