Lääketieteen asiantuntija
Uudet julkaisut
Kurkkumädän syyt ja patogeneesi
Viimeksi tarkistettu: 04.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
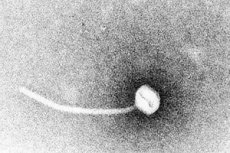
Kurkkumätä on esimerkki toksigeenisistä tartuntataudeista. Vuonna 1883 Klebs osoitti, että Corynebacterium diphtheriae oli kurkkumädän aiheuttaja. Vuotta myöhemmin Loeffler havaitsi, että organismia voitiin viljellä vain nenänielun ontelosta, ja ehdotti, että sisäelinten vauriot johtuivat liukoisesta toksiinista. Vuoteen 1888 mennessä Roux ja Yersin osoittivat, että eläimille, joihin injektoitiin steriilejä C. diphtheriae -suodoksia, kehittyi elinsairauksia, jotka eivät eronneet ihmisen kurkkumädästä; tämä osoitti, että voimakas eksotoksiini oli tärkein virulenssitekijä.
Kurkkumätä on useimmiten ylähengitysteiden infektio, joka aiheuttaa kuumetta, kurkkukipua ja huonovointisuutta. Paksu, harmaanvihreä fibriinikalvo, pseudomembraani, muodostuu usein infektiokohtaan/-kohtiin bakteerien kasvun, toksiinituotannon, taustalla olevan kudosnekroosin ja isännän immuunivasteen yhteisvaikutuksen seurauksena. Sen ymmärtäminen, että systeemiset elinvauriot johtuvat difteriatoksiinin toiminnasta, on johtanut sekä tehokkaan antitoksiinipohjaisen hoidon kehittämiseen akuutin infektion hoitoon että erittäin tehokkaan toksoidirokotteen kehittämiseen.
Vaikka toksoidirokotus on tehnyt kurkkumädästä harvinaisen taudin alueilla, joilla kansanterveysstandardit edellyttävät rokottamista, kurkkumätäepidemioita esiintyy edelleen rokottamattomissa ja immuunipuutteisissa ryhmissä. Sitä vastoin alueilla, joilla aktiiviset rokotusohjelmat on keskeytetty, on esiintynyt laajalle levinneitä ja epidemian mittasuhteita saavuttaneita kurkkumätäepidemioita.
Muita korynebakteereja
C. diphtheriaen, C. ulceransin ja C. pseudotuberculosisin lisäksi C. pseudodiphtheriticum ja C. xerosis voivat toisinaan aiheuttaa nenänielun ja ihon infektioita. Kaksi jälkimmäistä kantaa tunnistetaan kyvystään tuottaa pyratsinamidaasia. Eläinlääketieteessä C. renale ja C. kutscheri ovat tärkeitä taudinaiheuttajia, jotka aiheuttavat vastaavasti pyelonefriittiä naudoilla ja piileviä infektioita hiirillä.
Syyt
Kurkkumätän aiheuttaja, Corynebacterium diphtheriae, on ohut, hieman kaareva sauva, jonka päissä on mailanmuotoisia paksuuntumia, liikkumaton; se ei muodosta itiöitä, kapseleita tai siimoja ja on grampositiivinen.
Toksiinin lisäksi difteriakorynebakteerit tuottavat elintoimintojensa aikana neuraminidaasia, hyaluronidaasia, hemolysiiniä, nekrotisoivia ja diffuusisia tekijöitä, jotka voivat aiheuttaa sidekudoksen pääaineen nekroosia ja nesteytymistä.
Toksinmuodostuskyvyn perusteella difteriakorynebakteereja jaetaan toksigeenisiin ja ei-toksigeenisiin.
Difteriatoksiini on voimakas bakteeriperäinen eksotoksiini, joka aiheuttaa sekä taudin yleisiä että paikallisia kliinisiä ilmenemismuotoja. Toksigeenisyys on geneettisesti määräytyvää. Ei-toksigeeniset difterian korynebakteerit eivät aiheuta tautia.
Viljelys- ja morfologisten ominaisuuksien mukaan kaikki difteriakorynebakteerit jaetaan kolmeen varianttiin: gravis, mitis ja intermedius. Taudin vaikeusasteella ei ole suoraa riippuvuutta difteriakorynebakteerin variantista. Jokainen variantti sisältää sekä toksigeenisia että ei-toksigeenisia kantoja. Kaikkien varianttien toksigeeniset korynebakteerit tuottavat identtistä toksiinia. [ 1 ]
Rakenne, luokittelu ja antigeenityypit
Corynebacterium diphtheriae on grampositiivinen, liikkumaton, nuijanmuotoinen sauvabakteeri. Kudos- tai vanhemmissa in vitro -viljelmissä kasvavilla kannoilla on soluseinissä hienoja täpliä, jotka mahdollistavat värin haihtumisen Gram-värjäyksen aikana ja johtavat vaihtelevaan Gram-reaktioon. Vanhemmissa viljelmissä on usein metakromaattisia rakeita (polymetafosfaatti), jotka värjäytyvät sinertävän violeteiksi metyleenisinellä. Soluseinän sokereita ovat arabinoosi, galaktoosi ja mannoosi. Lisäksi voidaan eristää trehaloosin myrkyllinen 6,6'-esteri, joka sisältää korynemykoli- ja korynemykoleenihappoja ekvimolaarisina pitoisuuksina. Tunnetaan kolme erillistä viljelmätyyppiä: mitis, intermedius ja gravis.
Useimmat kannat tarvitsevat kasvuun nikotiini- ja pantoteenihappoja; jotkut tarvitsevat myös tiamiinia, biotiinia tai pimeliinihappoa. Optimaalisen difteriatoksiinin tuotannon varmistamiseksi kasvualustaa on täydennettävä aminohapoilla ja se on laitettava sivuun.
Jo vuonna 1887 Loeffler kuvasi avirulenttien (ei-toksigeenisten) C. diphtheriae -kantojen eristämisen, joita ei voitu erottaa terveiden yksilöiden potilaista eristetyistä virulenteista (toksigeenisistä) kannoista. Nykyään tiedetään, että avirulentit C. diphtheriae -kannat voivat muuttua virulentiksi fenotyypiksi infektion ja difteriatoksiinin rakennegeeniä, tox, kantavan korynebakteriofagin lysogenisaation jälkeen. Avirulentin fenotyypin lysogeeninen muuntuminen virulentiksi fenotyypiksi voi tapahtua sekä in situ että in vitro. Difteriatoksiinin rakennegeeni ei ole välttämätön korynebakteriofagille eikä C. diphtheriae -bakteerille. Tästä havainnosta huolimatta difteriatoksiinin geneettistä ajautumista ei ole havaittu.
Synnyssä
Infektio pääsee nielun, nenän ja kurkunpään limakalvojen kautta, harvemmin silmien ja sukupuolielinten limakalvojen kautta, sekä vaurioituneen ihon, haava- tai palovammapintojen, vaippaihottuman ja paranemattoman napanuoran kautta. Infektiopaikassa difteria-corynebakteeri lisääntyy ja erittää eksotoksiinia.
Fibrinogeenirikas erite erittyy ja muuttuu fibriiniksi epiteelisolujen nekroosin aikana vapautuvan trombokinaasin vaikutuksesta. Muodostuu fibriinikalvo - difterian tyypillinen merkki.
Oireeton nenänielun kantajuus on yleistä difterian endeemisillä alueilla. Alttiilla yksilöillä toksiinikannat aiheuttavat taudin replikoitumalla ja erittämällä difteriatoksiinia nenänieluun tai ihovaurioihin. Difterialeesio on usein peitetty pseudomembraanilla, joka koostuu fibriinistä, bakteereista ja tulehdussoluista. Difteriatoksiini voidaan proteolyyttisesti pilkkoa kahdeksi fragmentiksi: N-terminaalinen fragmentti A (katalyyttinen domeeni) ja fragmentti B (transmembraaninen ja reseptoriin sitoutuva domeeni). Fragmentti A katalysoi elongaatiotekijä 2:n NAD+-riippuvaista ADP-ribosylaatiota, estäen siten proteiinisynteesiä eukaryoottisoluissa. Fragmentti B sitoutuu solun pintareseptoriin ja helpottaa fragmentti A:n kulkeutumista sytosoliin.
Suojaava immuniteetti käsittää vasta-ainevasteen difteriatoksiinille kliinisen sairauden jälkeen tai difteriatoksiinille (formaldehydillä inaktivoitu toksiini) immunisaation jälkeen.
Kolonisaatio
C. diphtheriaen kolonisaatioon vaikuttavista tekijöistä tiedetään kuitenkin vähän. On kuitenkin selvää, että muut tekijät kuin difteriatoksiinin tuotanto vaikuttavat virulenssiin. Epidemiologiset tutkimukset ovat osoittaneet, että tietty lysotyyppi voi säilyä populaatiossa pitkiä aikoja. Myöhemmin toinen lysotyyppi voi korvata sen. Uuden lysotyypin syntyminen ja sitä seuraava dominointi populaatiossa liittyy oletettavasti sen kykyyn kolonisoida ja kilpailla tehokkaasti nenänielun ekologisen lokeron omalla segmentillään. Corynebacterium diphtheriae voi tuottaa neuraminidaasia, joka pilkkoo solun pinnalla olevan siaalihapon komponenteikseen pyruvaatiksi ja N-asetyylineuramiinihapoksi. Corn-tekijä (6,6'-di-O-mykoloyyli-α, α'-D-trehaloosi) on C. diphtheriaen pintakomponentti, mutta sen rooli ihmisisännän kolonisaatiossa on epäselvä.
Difteria-toksiinien tuotanto
Difteriatoksiinin rakennegeeni, tox, kuuluu läheisesti sukua olevien korynebakteriofagien perheeseen, joista β-faagi on parhaiten tutkittu. Difteriatoksiinin ilmentymistä säätelee raudan aktivoima repressori, DtxR, jota koodaa C. diphtheriae -genomi. Toksiinin ilmentyminen riippuu C. diphtheriae -bakteerin fysiologisesta tilasta. Olosuhteissa, joissa raudasta tulee kasvunopeutta rajoittava substraatti, rauta irtoaa DtxR:stä, toksikodendronigeeni aktivoituu ja difteriatoksiinia syntetisoidaan ja eritetään viljelyalustaan maksimaalisella nopeudella.
Difteriatoksiini on epätavallisen voimakas; herkille lajeille (esim. ihmisille, apinoille, kaneille, marsuille) jo 100–150 ng/kg ruumiinpainoa on tappava. Difteriatoksiini koostuu yhdestä 535 aminohapon polypeptidiketjusta. Biokemiallinen, geneettinen ja röntgenrakenteinen analyysi osoittaa, että toksiini koostuu kolmesta rakenteellisesta/toiminnallisesta domeenista:
- N-terminaalinen ADP-ribosyylitransferaasi (katalyyttinen domeeni);
- alue, joka helpottaa katalyyttisen domeenin kulkeutumista solukalvon läpi (transmembraanidomeeni);
- eukaryoottisolujen reseptoria sitova domeeni.
Kevyen trypsiinikäsittelyn ja denaturoivissa olosuhteissa tapahtuvan pelkistyksen jälkeen difteriatoksiini voidaan pilkkoa spesifisesti proteaasiherkästä silmukastaan kahdeksi polypeptidifragmentiksi (A ja B). Fragmentti A on toksiinin N-terminaalinen 21 kDa:n komponentti ja sisältää katalyyttisen kohdan elongaatiotekijä 2:n (EF-2) ADP-ribosylaatiolle.
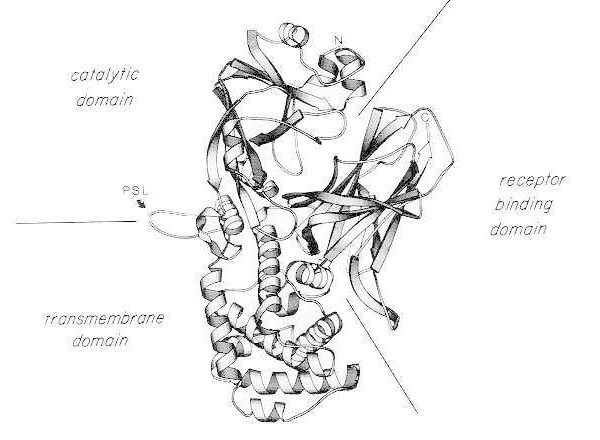
Monomeerisen natiivin difteriatoksiinin röntgenkristallirakenteen nauhakaavio. (muokattu julkaisusta Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling alliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Katalyyttisten, transmembraanisten ja reseptoria sitovien domeenien suhteelliset sijainnit on esitetty. Trypsiinin kaltaiset proteaasit voivat pilkkoa ehjän toksiinin Arg190-, Arg192- ja/tai Arg193-kohdissa, jotka sijaitsevat proteaasiherkässä silmukassa (PSL). Cys186:n ja Cys201:n välisen disulfidisillan pelkistymisen jälkeen toksiini voidaan erottaa A- ja B-fragmenteiksi. Ehjän toksiinin aminoterminaali (N) ja karboksiterminaali (C) on esitetty. Nauhakaavio luotiin MOLESCRIPT-ohjelmalla.
C-terminaalinen fragmentti, fragmentti B, kantaa toksiinin transmembraanisia ja reseptoria sitovia domeeneja.
Yhden eukaryoottisolun myrkyttäminen difteriatoksiinilla käsittää vähintään neljä erillistä vaihetta:
- toksiinin sitoutuminen reseptoriinsa solun pinnalla;
- varautuneiden reseptorien kasautuminen päällystetyiksi kuopiksi ja toksiinin sisäänotto reseptorivälitteisen endosytoosin kautta; endosyyttisen vesikkelin happamoitumisen jälkeen kalvoon liittyvällä, ATP:n ohjaamalla protonipumpulla,
- transmembraanisen domeenin insertio kalvoon ja katalyyttisen domeenin kulkeutumisen helpottaminen sytosoliin, ja
- EF-2:n ADP-ribosylaatio, mikä johtaa proteiinisynteesin peruuttamattomaan suppressioon.
On osoitettu, että yksi katalyyttisen domeenin molekyyli sytosoliin toimitettuna riittää olemaan solulle tappava.
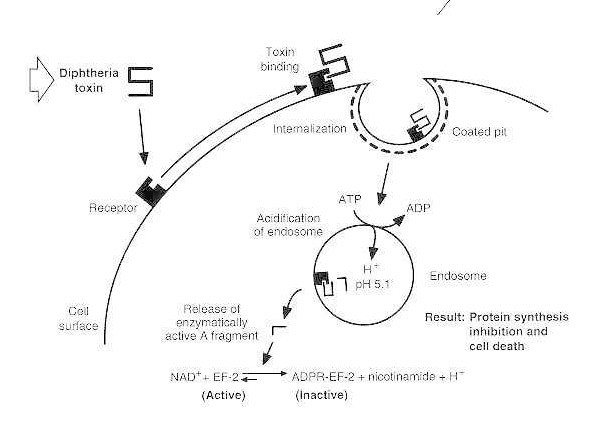
Kaaviokuva alttiiden eukaryoottisolujen difteriamyrkytyksestä.
Toksiini sitoutuu solun pintareseptoriinsa ja internalisoituu reseptorivälitteisen endosytoosin kautta; endosomin happamoittuessa transmembraaninen domeeni kiinnittyy vesikkelikalvoon; katalyyttinen domeeni kulkeutuu sytosoliin, mikä johtaa proteiinisynteesin estymiseen ja solukuolemaan.
Epidemiologia
Ennen Yhdysvaltain väestön massarokotustoimenpiteitä difteriatoksoidilla, kurkkumätä oli yleensä lapsuusiän sairaus. Merkittävä piirre difteriatoksoidilla tehtävässä massarokotustoiminnassa on se, että kun väestön prosenttiosuus, jolla on suojaava antitoksiiniimmuniteettitaso (≥ 0,01 IU/ml), kasvaa, toksigeenisten kantojen eristämisen esiintymistiheys väestöstä vähenee. Nykyään Yhdysvalloissa, jossa kliininen kurkkumätä on lähes kokonaan kadonnut, toksigeenisten C. diphtheriae -kantojen eristäminen on harvinaista. Koska subkliininen infektio ei enää tarjoa altistumista difteriaantigeenille ja ellei sitä tehosteta, immuniteetti antitoksiinille heikkenee, suurella osalla aikuisista (30–60 %) antitoksiinitasot ovat suojaavan tason alapuolella ja he ovat vaarassa. Yhdysvalloissa, Euroopassa ja Itä-Euroopassa viimeaikaiset difteriaepidemiat ovat esiintyneet pääasiassa alkoholin ja/tai huumeiden väärinkäyttäjillä. Tässä ryhmässä toksigeenisen C. diphtheriae -bakteerin kantajilla on kohtalaisen korkea antitoksiiniimmuniteetti. Venäjän kansanterveystoimenpiteiden viimeaikainen romahtaminen on johtanut siihen, että kurkkumädästä on tullut epidemia. Vuoden 1994 loppuun mennessä Venäjällä oli raportoitu yli 80 000 tapausta ja yli 2 000 kuolemantapausta.
Difteriaepidemian fokaaliset epidemiat liittyvät lähes aina immuunikantajaan, joka on palannut alueelta, jolla difteriaa esiintyy endeemisenä. Itse asiassa Yhdysvalloissa ja Euroopassa viimeaikaiset kliinisen difterian epidemiat ovat liittyneet Venäjältä ja Itä-Euroopasta palaaviin matkailijoihin. C. diphtheriae -bakteerin toksigeeniset kannat tarttuvat suoraan ihmisestä toiseen ilmassa olevien pisaroiden välityksellä. Tiedetään, että toksigeeniset kannat voivat asuttaa nenänielun onteloa suoraan. Lisäksi toksigeeninen geeni voi levitä epäsuorasti toksigeenisen korynebakteriofagin vapautumisen ja ei-toksigeenisen alkuperäisen C. diphtheriae -bakteerin lysogeenisen transformaation kautta in situ. [ 5 ]
C. diphtheriae -isolaattien biotyypin ja lysotyypin määrityksen lisäksi molekyylibiologian tekniikoita voidaan nyt käyttää kurkkumätäepidemioiden tutkimiseen. C. diphtheriae -kromosomin DNA:n restriktioendonukleaasientsyymillä tehtyjä pilkkomismalleja on käytetty kliinisten epidemioiden tutkimiseen, samoin kuin kloonattujen korynebakteerien insertiosekvenssejä geneettisenä koettimena.
Schickin testiä on käytetty jo vuosia difteriatoksiinin immuniteetin arvioimiseen, vaikka se on nykyään monilla alueilla korvattu serologisella testillä, joka suorittaa spesifisiä difteriatoksiinin vasta-aineita. Schickin testissä pieni määrä difteriatoksiinia (noin 0,8 ng 0,2 ml:ssa) injektoidaan ihon alle kyynärvarteen (testikohtaan) ja 0,0124 μg difteriatoksiinia 0,2 ml:ssa injektoidaan ihon alle kontrollikohtaan. Lukemat otetaan 48 ja 96 tunnin kuluttua. Epäspesifiset ihoreaktiot ovat yleensä huipussaan 48 tunnin kuluttua. 96 tunnin kohdalla eryteemaattinen reaktio, johon liittyy mahdollisesti nekroosia testikohdassa, osoittaa riittämättömän antitoksisen immuniteetin toksiinin neutraloimiseksi (≤ 0,03 IU/ml). Tulehdus sekä testi- että kontrollialueella 48 tunnin kuluttua osoittaa yliherkkyysreaktion antigeenivalmisteelle.
Lomakkeet
Corynebacterium diphtheriae tarttuu nenänieluun tai ihoon. Toksigeeniset kannat tuottavat voimakasta eksotoksiinia, joka voi aiheuttaa kurkkumätää. Kurkkumädän oireita ovat nielutulehdus, kuume ja kaulan tai ihovaurion ympäristön turvotus. Kurkkumätävauriot peittyvät pseudokalvoon. Toksiini leviää verenkierron mukana kaukaisiin elimiin ja voi aiheuttaa halvaantumisen ja sydämen vajaatoiminnan. [ 6 ]
Kliinistä kurkkumätää on kahdenlaisia: nenänielun ja ihon kurkkumätää. Nielun kautta tapahtuvan kurkkumädän oireet vaihtelevat lievästä nielutulehduksesta pseudokalvon aiheuttaman hengitysteiden tukkeutumisen aiheuttamaan hypoksiaan. Kohdunkaulan imusolmukkeiden tulehdukset voivat aiheuttaa voimakasta kaulan turvotusta (häränniskadifteria), ja potilaalle voi kehittyä kuumetta (≥ 38 °C). Ihon kautta tapahtuvan kurkkumädän ihovauriot ovat yleensä harmaanruskean pseudokalvon peitossa. Hengenvaarallisia systeemisiä komplikaatioita, pääasiassa motoristen toimintojen menetys (esim. nielemisvaikeudet) ja sydämen vajaatoiminta, voi kehittyä difteriatoksiinin vaikutuksesta ääreisveren motorisiin hermosoluihin ja sydänlihakseen.
Ohjaus
Difterian torjunta riippuu riittävästä immunisaatiosta difteriatoksiinilla: formaldehydillä inaktivoidulla difteriatoksiinilla, joka pysyy antigeenisesti ehjänä. Toksoidi valmistetaan inkuboimalla difteriatoksiinia formaldehydin kanssa 37 °C:ssa emäksisissä olosuhteissa. Difteriarokotus tulisi aloittaa toisen elinkuukauden aikana kolmen perusrokotusannoksen sarjalla 4–8 viikon välein, minkä jälkeen neljäs annos annetaan noin vuoden kuluttua viimeisestä perusrokotuksesta. Difteriatoksiinia käytetään laajalti osana difteria-hinkuyskä-jäykkäkouristus (DPT) -rokotetta. Epidemiologiset tutkimukset ovat osoittaneet, että difteriaa vastaan rokotus on noin 97-prosenttisesti tehokas. Vaikka Yhdysvalloissa ja Euroopassa harjoitetaan massarokotuksia difteriaa vastaan ja lapsuusiän rokotusprosentit ovat riittävät, suurella osalla aikuisväestöstä voi olla vasta-ainetiitterit suojaavan tason alapuolella. Aikuiset tulisi rokottaa difteriatoksiinilla uudelleen 10 vuoden välein. Tehosterokotus difteria-tetanustoksoidilla tulisi antaa matkustajille, jotka matkustavat alueille, joilla esiintyy paljon endeemistä kurkkumätää (Keski- ja Etelä-Amerikka, Afrikka, Aasia, Venäjä ja Itä-Eurooppa). Viime vuosina erittäin puhdistettujen toksoidivalmisteiden käyttö immunisaatiossa on minimoinut satunnaisia vakavia yliherkkyysreaktioita. Tehosterokotus difteria-tetanustoksoidilla tulisi antaa matkustajille, jotka matkustavat alueille, joilla esiintyy paljon endeemistä kurkkumätää (Keski- ja Etelä-Amerikka, Afrikka, Aasia, Venäjä ja Itä-Eurooppa). Viime vuosina erittäin puhdistettujen toksoidivalmisteiden käyttö immunisaatiossa on minimoinut satunnaisia vakavia yliherkkyysreaktioita. Tehosterokotus difteria-tetanustoksoidilla tulisi antaa matkustajille, jotka matkustavat alueille, joilla esiintyy paljon endeemistä kurkkumätää (Keski- ja Etelä-Amerikka, Afrikka, Aasia, Venäjä ja Itä-Eurooppa). Viime vuosina erittäin puhdistettujen toksoidivalmisteiden käyttö immunisaatiossa on minimoinut satunnaisia vakavia yliherkkyysreaktioita.
Vaikka antibiootteja (kuten penisilliiniä ja erytromysiiniä) käytetään osana kurkkumätäpotilaiden hoitoa, nopea passiivinen immunisaatio difteria-antitoksiinilla on tehokkain tapauskuolleisuuden vähentämisessä. Spesifisen antitoksiinin pitkä puoliintumisaika verenkierrossa on tärkeä tekijä difteriatoksiinin tehokkaan neutraloinnin varmistamisessa; ollakseen tehokas antitoksiinin on kuitenkin reagoitava toksiinin kanssa ennen kuin se voi päästä soluun.
Difteriatoksiinin uudelleenmuokkaus eukaryoottireseptorispesifisten sytotoksiinien kehittämiseksi
Proteiinitekniikka on uusi ja nopeasti kehittyvä ala molekyylibiologiassa; se yhdistää rekombinantti-DNA-menetelmiä ja kiinteän faasin DNA-synteesiä suunnitellakseen ja rakentaakseen kimeerisiä geenejä, joiden tuotteilla on ainutlaatuisia ominaisuuksia. Difteriatoksiinin rakenne-toimintasuhteiden tutkimukset ovat selvästi osoittaneet, että tämä toksiini on kolmidomeeniproteiini: katalyyttinen, transmembraaninen ja reseptoridomeeni. Difteriatoksiinin natiivi reseptoriin sitoutuva domeeni on voitu korvata geneettisesti erilaisilla polypeptidihormoneilla ja sytokiineilla (esim. α-melanosyyttejä stimuloiva hormoni [α-MSH], interleukiini (IL) 2, IL-4, IL-6, IL-7, epidermaalinen kasvutekijä). Tuloksena olevat kimeeriset proteiinit tai fuusiotoksiinit yhdistävät sytokiinin reseptoriin sitoutumisspesifisyyden toksiinin transmembraanisiin ja katalyyttisiin domeeneihin. Jokaisessa tapauksessa fuusiotoksiinien osoitettiin myrkyttävän selektiivisesti vain ne solut, joissa on vastaava kohdereseptori. Ensimmäistä näistä geneettisesti muunnelluista fuusiotoksiineista, DAB 389IL-2:ta, arvioidaan parhaillaan kliinisissä ihmiskokeissa hoitoon refraktaarisissa lymfoomissa ja autoimmuunisairauksissa, joissa korkean affiniteetin IL-2-reseptoreita omaavilla soluilla on tärkeä rooli patogeneesissä.[ 7 ] DAB 389 IL-2:n antaminen osoitettiin turvalliseksi, hyvin siedetyksi ja kykeneväksi indusoimaan kestävän taudin remission ilman vakavia sivuvaikutuksia. On todennäköistä, että difteriatoksiiniin perustuvista fuusiotoksiineista tulee tärkeitä uusia biologisia aineita tiettyjen kasvainten tai sairauksien hoitoon, joissa voidaan kohdistaa tiettyjä solun pintareseptoreita.


 [
[