Lääketieteen asiantuntija
Uudet julkaisut
Corynebacterium
Viimeksi tarkistettu: 06.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
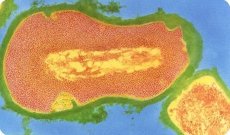
Kurkkumätä on akuutti tartuntatauti, joka vaikuttaa pääasiassa lapsiin ja ilmenee elimistön syvänä kurkkumätätoksiinin myrkytyksenä ja taudinaiheuttajan lokalisoitumiskohdassa tyypillisenä fibriinisenä tulehduksena. Taudin nimi tulee kreikan sanasta diphthera - iho, kalvo, koska taudinaiheuttajan lisääntymiskohtaan muodostuu tiheä, harmahtavanvalkoinen kalvo.
Kurkkumädän aiheuttaja, Corynebacterium diphtheriae, löydettiin ensimmäisen kerran vuonna 1883 E. Klebsin toimesta filminäytteistä, ja F. Leffler eristi sen puhtaana viljelmänä vuonna 1884. Vuonna 1888 E. Roux ja A. Yersin löysivät sen kyvyn tuottaa eksotoksiinia, jolla on merkittävä rooli kurkkumädän etiologiassa ja patogeneesissä. E. Behringin vuonna 1892 valmistama antitoksinen seerumi ja sen käyttö kurkkumädän hoitoon vuodesta 1894 lähtien mahdollisti kuolleisuuden merkittävän vähentämisen. Onnistunut hyökkäys tätä tautia vastaan alkoi vuoden 1923 jälkeen G. Raionin kehittämän menetelmän yhteydessä kurkkumädän toksiinin saamiseksi.
Kurkkumädän aiheuttaja kuuluu Corynebacterium-sukuun (luokka Actinobacteria). Morfologisesti sille on ominaista, että solut ovat nuijamaisia ja päistään paksuuntuneita (kreikaksi coryne - nuija), muodostavat haaroja, erityisesti vanhoissa viljelmissä, ja sisältävät rakeisia sulkeumia.
Corynebacterium-sukuun kuuluu suuri määrä lajeja, jotka jaetaan kolmeen ryhmään.
- Korynebakteerit ovat ihmisten ja eläinten loisia ja niille patogeenisiä.
- Kasveille patogeenisiä korynebakteereja.
- Ei-patogeeniset korynebakteerit. Monet korynebakteerilajit ovat normaaleja ihon, nielun, nenänielun, silmien, hengitysteiden, virtsaputken ja sukupuolielinten limakalvojen asukkaita.
Korynebakteerien morfologia
C. diphtheriae -bakteerit ovat suoria tai hieman kaarevia, liikkumattomia sauvoja, joiden pituus on 1,0–8,0 μm ja halkaisija 0,3–0,8 μm; ne eivät muodosta itiöitä tai kapseleita. Niillä on usein turpoamista toisessa tai molemmissa päissä ja ne sisältävät usein metakromaattisia rakeita - volutiinijyviä (polymetafosfaatteja), jotka saavat sinertävän violetin värin metyleenisinellä värjättäessä. Niiden havaitsemiseen on ehdotettu erityinen Neisser-värjäysmenetelmä. Tässä tapauksessa sauvat värjäytyvät oljenkeltaisiksi ja volutiinijyvät ovat tummanruskeita ja sijaitsevat yleensä navoilla. Corynebacterium diphtheriae värjäytyy hyvin aniliiniväreillä, on grampositiivinen, mutta vanhoissa viljelmissä se usein värjäytyy ja sillä on gramnegatiivinen värjäymä. Sille on ominaista voimakas polymorfismi, erityisesti vanhoissa viljelmissä ja antibioottien vaikutuksen alaisena. DNA:n G + C-pitoisuus on noin 60 mol-%.
Korynbakteerien biokemialliset ominaisuudet
Difteriabasilli on aerobinen tai fakultatiivinen anaerobi, jonka kasvun optimaalinen lämpötila on 35–37 °C (kasvurajat 15–40 °C) ja optimaalinen pH on 7,6–7,8. Se ei ole kovin vaativa ravinnealustoille, mutta kasvaa paremmin seerumia tai verta sisältävällä alustalla. Roux- tai Loeffler-juoksutuneen seerumin alustat ovat selektiivisiä difteriabakteereille , ja niissä kasvua esiintyy 8–12 tunnin kuluttua kuperia, nuppineulanpään kokoisia, harmahtavanvalkoisia tai kellertävän kermanvärisiä pesäkkeitä. Niiden pinta on sileä tai hieman rakeinen, ja reunoilla pesäkkeet ovat hieman läpinäkyvämpiä kuin keskellä. Pesäkkeet eivät yhdisty, minkä seurauksena viljelmä saa shagreen-nahan ulkonäön. Liemessä kasvu ilmenee tasaisena sameutena tai liemi pysyy läpinäkyvänä, ja sen pinnalle muodostuu ohut kalvo, joka vähitellen paksuuntuu, murenee ja laskeutuu hiutaleiksi pohjalle.
Difteriabakteerien ominaisuus on niiden hyvä kasvu veri- ja seerumialustoissa, jotka sisältävät sellaisia pitoisuuksia kaliumtelluriittia, että ne estävät muiden bakteerityyppien kasvua. Tämä johtuu siitä, että C. diphtheriae pelkistää kaliumtelluuriitin metalliseksi telluuriksi, joka mikrobisoluihin kerrostuessaan antaa pesäkkeille tunnusomaisen tummanharmaan tai mustan värin. Tällaisten alustojen käyttö lisää difteriabakteerien kylväytymisprosenttia.
Corynebacterium diphtheriae fermentoi glukoosia, maltoosia ja galaktoosia muodostaen happoa ilman kaasua, mutta ei fermentoi (yleensä) sakkaroosia, niillä on kystinaasia, ei ureaasia eivätkä ne muodosta indolia. Näiden ominaisuuksien mukaan ne eroavat niistä koryneformisista bakteereista (difteroideista), joita esiintyy useimmiten silmän limakalvolla (Corynebacterium xerosus) ja nenänielun limakalvolla (Corynebacterium pseiidodiphtheriticum), sekä muista difteroideista.
Luonnossa difteriabasillista on kolme pääasiallista varianttia (biotyyppiä): gravis, intermedins ja mitis. Ne eroavat toisistaan morfologisten, viljelyllisten, biokemiallisten ja muiden ominaisuuksien osalta.
Difteriabakteerien jako biotyyppeihin tehtiin ottaen huomioon potilaiden difterian muodot, joilla niitä eristetään useimmiten. Gravis-tyyppi eristetään useimmiten vaikeaa kurkkumätää sairastavilta potilailta ja aiheuttaa ryhmäepidemioita. Mitis-tyyppi aiheuttaa lievempiä ja satunnaisempia tautitapauksia, ja intermedius-tyyppi on niiden välissä. Corynebacterium belfanti, joka aiemmin luokiteltiin mitis-biotyypiksi, on eristetty itsenäisenä, neljäntenä biotyyppinä. Sen tärkein ero gravis- ja mitis-biotyyppeihin on kyky pelkistää nitraatteja nitriiteiksi. Corynebacterium belfanti -kannoilla on voimakkaat adhesiiviset ominaisuudet, ja niiden joukossa on sekä toksigeenisiä että ei-toksigeenisiä variantteja.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Korynebakteereiden antigeeninen rakenne
Corynebacterium on hyvin heterogeeninen ja mosaiikkinen. Kaikista kolmesta difteriapatogeenityypistä on löydetty useita kymmeniä somaattisia antigeenejä, joiden mukaan ne jaetaan serotyyppeihin. Venäjällä on käytössä serologinen luokittelu, jonka mukaan erotetaan 11 difteriabakteerin serotyyppiä, joista 7 on pääasiallisia (1-7) ja 4 on muita, harvoin esiintyviä serotyyppejä (8-11). Kuusi serotyyppiä (1, 2, 3, 4, 5, 7) kuuluu gravis-tyyppiin ja viisi (6, 8, 9, 10, 11) mitis-tyyppiin. Serotyypitysmenetelmän haittapuolena on, että monilla kannoilla, erityisesti ei-toksigeenisillä, on spontaani agglutinaatio tai polyagglutinaatiokyky.
 [ 11 ]
[ 11 ]
Corynebacterium diphtheriaen faagityypitys
Difteriabakteerien erottamiseksi on ehdotettu erilaisia faagityypitysmenetelmiä. MD Krylovan menetelmän mukaan yhdeksän faagin (A, B, C, D, F, G, H, I, K) avulla on mahdollista tyypittää useimmat gravis-tyypin toksigeeniset ja ei-toksigeeniset kannat. Ottaen huomioon herkkyyden tietyille faageille sekä viljelyominaisuudet, antigeeniset ominaisuudet ja kyvyn syntetisoida korysiineja (bakterisidisiä proteiineja), MD Krylova tunnisti kolme itsenäistä gravis-tyypin korynebakteereiden ryhmää (I-III). Jokainen niistä sisältää difteriapatogeenien toksigeenisten ja ei-toksigeenisten analogien alaryhmiä.
Corynebacterium-resistenssi
Corynebacterium diphtheriae kestää hyvin alhaisia lämpötiloja, mutta kuolee nopeasti korkeissa lämpötiloissa: 60 °C:ssa 15–20 minuutissa, kiehuessa 2–3 minuutissa. Kaikki desinfiointiaineet (lysoli, fenoli, kloramiini jne.) tavallisesti käytetyssä pitoisuudessa tuhoavat sen 5–10 minuutissa. Difteriabakteeri sietää kuitenkin hyvin kuivumista ja voi säilyä elinkelpoisena pitkään kuivuneessa limassa, syljessä ja pölyhiukkasissa. Hienojakoisessa aerosolissa difteriabakteerit pysyvät elinkelpoisina 24–48 tuntia.
Korynebakteereiden patogeenisuustekijät
Corynebacterium diphtheriaen patogeenisuus määräytyy useiden tekijöiden perusteella.
Adheesion, kolonisaation ja invaasion tekijät
Adheesiosta vastaavia rakenteita ei ole tunnistettu, mutta ilman niitä difteriabasilli ei pystyisi kolonisoimaan soluja. Niiden roolia hoitavat jotkin patogeenin soluseinän komponentit. Patogeenin invasiiviset ominaisuudet liittyvät hyaluronidaasiin, neuraminidaasiin ja proteaasiin.
Patogeenin soluseinässä oleva myrkyllinen glykolipidi. Se on trehaloosin 6,6'-diesteri, joka sisältää korynemykolihappoa (C32H64O3) ja korynemykolihappoa (C32H62O3) ekvimolaarisissa suhteissa (trehaloosi-6,6'-dikorynemikolaatti). Glykolipidillä on tuhoisa vaikutus patogeenin lisääntymispaikan kudossoluihin.
Eksotoksiini, joka määrittää taudinaiheuttajan patogeenisyyden ja taudin patogeneesin luonteen. C. diphtheriaen ei-toksigeeniset variantit eivät aiheuta kurkkumätää.
Eksotoksiini syntetisoidaan inaktiivisena esiasteena - yhtenä polypeptidiketjuna, jonka molekyylipaino on 61 kD. Bakteeriproteaasi aktivoi sen itse, pilkkomalla polypeptidin kahdeksi disulfidisidoksilla toisiinsa kytkeytyneeksi peptidiksi: A (m/m 21 kD) ja B (m/m 39 kD). Peptidi B toimii akseptorina - se tunnistaa reseptorin, sitoutuu siihen ja muodostaa kalvon sisäisen kanavan, jonka kautta peptidi A tunkeutuu soluun ja toteuttaa toksiinin biologisen aktiivisuuden. Peptidi A on ADP-ribosyylitransferaasientsyymi, joka varmistaa adenosiinidifosfaattiriboosin siirtymisen NAD:sta yhteen proteiinin elongaatiotekijä EF-2:n aminohappotähteistä (histidiini). Modifioinnin seurauksena EF-2 menettää aktiivisuutensa, ja tämä johtaa ribosomien proteiinisynteesin vaimennusvaiheessa. Toksiinia syntetisoivat vain ne C. diphtheriae -bakteerit, joilla on kohtalaisen konvertoivan profaagin geenit kromosomissaan. Toksiinin synteesiä koodaava operoni on monokistroninen, se koostuu 1,9 tuhannesta nukleotidiparista ja sillä on toxP-promoottori sekä kolme aluetta: toxS, toxA ja toxB. ToxS-alue koodaa signaalipeptidin 25 aminohappotähdettä (se varmistaa toksiinin vapautumisen kalvon läpi bakteerisolun periplasmiseen tilaan), toxA - peptidi A:n 193 aminohappotähdettä ja toxB - toksiinin peptidi B:n 342 aminohappotähdettä. Profaagin menetys solussa tai tox-operonin mutaatiot tekevät solusta hieman toksigeenisen. Sitä vastoin ei-toksigeenisten C. diphtheriae -bakteerien lysogenisaatio konvertoivan faagin avulla muuttaa ne toksigeenisiksi bakteereiksi. Tämä on todistettu yksiselitteisesti: difteriabakteerien toksigeenisyys riippuu niiden lysogenisaatiosta toksiinia konvertoivien korinefaagien avulla. Korynefagit integroituvat korynebakteerien kromosomiin kohdennetun rekombinaation mekanismilla, ja difteriabakteerikannat voivat sisältää kaksi rekombinaatiokohtaa (attB) kromosomeissaan, ja korynefagit integroituvat kumpaankin niistä samalla taajuudella.
Useiden ei-toksigeenisten difteriabakteerikantojen geneettinen analyysi, joka tehtiin käyttämällä merkittyjä DNA-koettimia, jotka sisälsivät korynefag tox -operonin fragmentteja, osoitti, että niiden kromosomit sisältävät korynefag tox -operonin kanssa homologisia DNA-sekvenssejä, mutta ne joko koodaavat inaktiivisia polypeptidejä tai ovat "hiljaisessa" tilassa eli inaktiivisessa tilassa. Tässä suhteessa herää erittäin tärkeä epidemiologinen kysymys: voivatko ei-toksigeeniset difteriabakteerit muuttua toksigeenisiksi luonnollisissa olosuhteissa (ihmiskehossa) samalla tavalla kuin tapahtuu in vitro? Mahdollisuus tällaiseen ei-toksigeenisten korynebakteeriviljelmien muuntumiseen toksigeenisiksi faagimuunnoksen avulla on osoitettu marsuilla, kanan alkioilla ja valkoisilla hiirillä tehdyissä kokeissa. Ei kuitenkaan ole vielä selvitetty, tapahtuuko tämä luonnollisen epidemian aikana (ja jos tapahtuu, kuinka usein).
Koska difteriatoksiinilla potilaiden kehossa on selektiivinen ja spesifinen vaikutus tiettyihin järjestelmiin (pääasiassa sympaattinen-lisämunuaisjärjestelmä, sydän, verisuonet ja ääreishermot), on ilmeistä, että se ei ainoastaan estä proteiinisynteesiä soluissa, vaan aiheuttaa myös muita häiriöitä niiden aineenvaihdunnassa.
Seuraavia menetelmiä voidaan käyttää difteriabakteerien myrkyllisyyden havaitsemiseen:
- Biologiset eläinkokeet. Marsujen ihonsisäinen infektointi difteriabakteerien liemiviljelmän suodoksella aiheuttaa nekroosin pistoskohdassa. Yksi pienin tappava toksiiniannos (20–30 ng) tappaa 250 g painavan marsun, kun se ruiskutetaan ihon alle 4.–5. päivänä. Toksiinin vaikutuksen tyypillisin ilmentymä on lisämunuaisten vaurio, jotka suurenevat ja lisääntyvät voimakkaasti.
- Kanan alkioiden infektio. Difteriatoksiini aiheuttaa niiden kuoleman.
- Soluviljelmien infektio. Difteriatoksiini aiheuttaa selvän sytopaattisen vaikutuksen.
- Kiinteän faasin entsyymi-immunosorbenttimääritys, jossa käytetään peroksidaasileimattuja antitoksiineja.
- DNA-koettimen käyttö tox-operonin suoraan havaitsemiseen difteriabakteerin kromosomissa.
Yksinkertaisin ja yleisin menetelmä difteriabakteerien myrkyllisyyden määrittämiseksi on kuitenkin serologinen - geelisaostusmenetelmä. Sen ydin on seuraava. Steriiliä suodatinpaperia, jonka mitat ovat 1,5 x 8 cm, kostutetaan antitoksisella difteriaseerumilla, joka sisältää 500 AE:tä 1 ml:ssa, ja levitetään ravintoalustan pinnalle petrimaljassa. Maljaa kuivataan termostaatissa 15-20 minuuttia. Testiviljelmät kylvetään siten, että paperin molemmille puolille on plakkeja. Useita kantoja kylvetään yhdelle maljalle, joista yksi, selvästi myrkyllinen, toimii kontrollina. Viljelmiä sisältävät levyt inkuboidaan 37 °C:ssa, ja tulokset otetaan huomioon 24-48 tunnin kuluttua. Antitoksiinin ja toksiinin vastadiffuusion vuoksi geelissä niiden vuorovaikutuskohtaan muodostuu selkeä saostusviiva, joka yhdistyy kontrollitoksigeenisen kannan saostusviivaan. Epäspesifiset saostumisvyöhykkeet (ne muodostuvat, jos seerumissa on antitoksiinin lisäksi pieniä määriä muita antimikrobisia vasta-aineita) ilmestyvät myöhään, ilmentyvät heikosti eivätkä koskaan yhdisty kontrollikannan saostumisvyöhykkeeseen.
Tartunnan jälkeinen immuniteetti
Vahvoja, pitkittyneitä, käytännössä elinikäisiä, toistuvia tautitapauksia havaitaan harvoin - 5-7 %:lla tautia sairastaneista. Immuniteetti on luonteeltaan pääasiassa antitoksinen, antimikrobiset vasta-aineet ovat vähemmän tärkeitä.
Schickin testiä käytettiin aiemmin laajalti kurkkumätäimmuniteetin tason arvioimiseen. Tätä varten lapsille injektoitiin ihon alle 1/40 marsun toksiinia 0,2 ml:n tilavuudessa. Antitoksisen immuniteetin puuttuessa injektiokohtaan ilmestyy 24–48 tunnin kuluttua yli 1 cm:n läpimittainen punoitus ja turvotus. Tällainen positiivinen Schickin reaktio osoittaa joko antitoksiinin täydellistä puuttumista tai sen pitoisuutta alle 0,001 AE/ml verta. Negatiivinen Schickin reaktio havaitaan, kun veren antitoksiinipitoisuus on yli 0,03 AE/ml. Jos antitoksiinipitoisuus on alle 0,03 AE/ml, mutta yli 0,001 AE/ml, Schickin reaktio voi olla joko positiivinen tai joskus negatiivinen. Lisäksi itse toksiinilla on voimakas allergeeninen ominaisuus. Siksi difteriaimmuniteetin tason (antitoksiinin kvantitatiivinen pitoisuus) määrittämiseksi on parempi käyttää RPGA:ta difteriatoksoidilla herkistettyjen punasolujen diagnostiikan kanssa.
Difterian epidemiologia
Tartunnan ainoa lähde on ihminen – sairas, toipuva tai terve bakteerin kantaja. Infektio tapahtuu ilmassa olevien pisaroiden, ilmassa olevan pölyn sekä sairaiden tai terveiden kantajien käyttämien esineiden, kuten astioiden, kirjojen, liinavaatteiden, lelujen jne., välityksellä. Elintarvikkeiden (maito, kermat jne.) saastumisen yhteydessä tartunta on mahdollista ruoansulatuskanavan kautta. Taudinaiheuttajan massiivisin erittyminen tapahtuu taudin akuutissa muodossa. Piileviä, epätyypillisiä taudin muotoja sairastavilla on kuitenkin suurin epidemiologinen merkitys, koska heitä ei usein hoideta sairaalahoidossa eikä heitä havaita välittömästi. Kurkkumätäpotilas on tarttuva koko taudin ajan ja osan toipumisajasta. Bakteerien keskimääräinen kantajuusaika toipuvilla ihmisillä vaihtelee 2–7 viikosta, mutta voi kestää jopa 3 kuukautta.
Terveillä kantajilla on erityinen rooli kurkkumädän epidemiologiassa. Sporaattisen sairastuvuuden olosuhteissa he ovat kurkkumädän tärkeimmät levittäjät ja edistävät taudinaiheuttajan säilymistä luonnossa. Toksigeenisten kantojen keskimääräinen kantajuusaika on jonkin verran lyhyempi (noin 2 kuukautta) kuin ei-toksogeenisten kantojen (noin 2–3 kuukautta).
Terveen, sekä toksiinia tuottavien että ei-toksiinia tuottavien difteriabakteerien kantajuuden muodostumisen syytä ei ole täysin selvitetty, koska edes korkea antitoksinen immuniteetti ei aina takaa elimistön täydellistä vapautumista taudinaiheuttajasta. Ehkä antibakteerisen immuniteetin tasolla on tietty merkitys. Ensisijainen epidemiologinen merkitys on difteriabakteerien toksiinia tuottavien kantojen kantajuudella.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ]
Kurkkumätän oireet
Kaikenikäiset ihmiset ovat alttiita kurkkumätälle. Taudinaiheuttaja voi tunkeutua ihmiskehoon eri elinten limakalvojen kautta tai vaurioituneen ihon läpi. Prosessin lokalisoinnista riippuen erotetaan nielun, nenän, kurkunpään, korvan, silmän, sukupuolielinten ja ihon kurkkumätä. Sekamuotoja on mahdollista, esimerkiksi nielun ja ihon kurkkumätä jne. Itämisaika on 2-10 päivää. Kliinisesti ilmentyneessä kurkkumätämuodossa taudinaiheuttajan lokalisointikohdassa kehittyy limakalvolle ominainen fibriininen tulehdus. Taudinaiheuttajan tuottama toksiini vaikuttaa ensin epiteelisoluihin ja sitten lähellä oleviin verisuoniin, mikä lisää niiden läpäisevyyttä. Ulos tuleva erite sisältää fibrinogeenia, jonka hyytyminen johtaa harmahtavanvalkoisen kalvomaisen pinnoitteen muodostumiseen limakalvon pinnalle, joka on tiiviisti kiinni alla olevassa kudoksessa ja repeytyessään aiheuttaa verenvuotoa. Verisuonten vaurioitumisen seurauksena voi olla paikallisen turvotuksen kehittyminen. Nielun kurkkumätä on erityisen vaarallinen, sillä se voi aiheuttaa kurkunpään kurkunpään limakalvon ja äänihuulten turvotuksen aiheuttaman kurkunpään kurkunpään kurkunpäähän liittyvän kurkunpään lantion turvotuksen vuoksi, johon aiemmin kuoli 50–60 % kurkkumätää sairastavista lapsista tukehtumiseen. Veren joutuessa kurkkumätätoksiini aiheuttaa yleisen, syvän myrkytyksen. Se vaikuttaa pääasiassa sydän- ja verisuonijärjestelmään, sympaattiseen-lisämunuaisjärjestelmään ja ääreishermoihin. Kurkkumädän oireet koostuvat siis yhdistelmästä paikallisia oireita, jotka riippuvat sisääntuloportin sijainnista, ja yleisiä oireita, jotka johtuvat toksiinin aiheuttamasta myrkytyksestä ja ilmenevät adynamiana, letargiana, kalpeana ihona, alhaisena verenpaineena, sydänlihastulehduksena, ääreishermojen halvaantumisena ja muina sairauksina. Rokotetuilla lapsilla kurkkumätä, jos sitä havaitaan, etenee yleensä lievässä muodossa ja ilman komplikaatioita. Kuolleisuus ennen seroterapian ja antibioottien käyttöä oli 50–60 %, nyt se on 3–6 %.
Difterian laboratoriodiagnostiikka
Difterian ainoa mikrobiologinen diagnostiikkamenetelmä on bakteriologinen, ja eristetyn korynebakteerviljelmän myrkyllisyys on pakollista testausta. Difterian bakteriologiset tutkimukset tehdään kolmessa tapauksessa:
- kurkkumätän diagnosointiin lapsilla ja aikuisilla, joilla on akuutteja tulehdusprosesseja nielun, nenän ja nenänielun alueella;
- difteria-taudinaiheuttajan lähteen kanssa kosketuksissa olleiden henkilöiden epidemiologisten merkintöjen mukaan;
- orpokoteihin, päiväkoteihin, sisäoppilaitoksiin ja muihin lasten ja aikuisten erityislaitoksiin äskettäin otetut henkilöt, jotta heistä voidaan tunnistaa mahdolliset kurkkumätäbasillin kantajat.
Tutkimuksen materiaalina käytetään nielun ja nenän limaa, nielurisojen tai muiden limakalvojen kalvoa, jotka ovat taudinaiheuttajan sisäänpääsyreitti. Kylvö tehdään telluriittiseerumille tai veriseerumille ja samanaikaisesti hyytyneelle Roux-seerumille (hyytyneelle hevosen seerumille) tai Loeffler-seerumille (3 osaa naudan seerumia + 1 osa sokerilientä), jolla korynebakteerien kasvua ilmenee 8–12 tunnin kuluttua. Eristetty viljelmä tunnistetaan morfologisten, viljelyllisten ja biokemiallisten ominaisuuksien yhdistelmällä käyttäen mahdollisuuksien mukaan sero- ja faagityypitysmenetelmiä. Kaikissa tapauksissa toksisuuskoe jollakin edellä mainituista menetelmistä on pakollinen. Korynebakteerien morfologisia ominaisuuksia tutkitaan parhaiten käyttämällä kolmea sivelynäytteen värjäysmenetelmää: Gram-, Neisser- ja metyleenisinivärjäystä (tai toluidiinisinivärjäystä).
Kurkkumätän hoito
Difterian spesifinen hoito on difteriaa torjuvan antitoksisen seerumin käyttö, joka sisältää vähintään 2000 IU / 1 ml. Seerumia annetaan lihaksensisäisesti 10 000 - 400 000 IU annoksina taudin vakavuudesta riippuen. Tehokas hoitomenetelmä on antibioottien (penisilliinit, tetrasykliinit, erytromysiini jne.) ja sulfonamidien käyttö. Omien antitoksiinien tuotannon stimuloimiseksi voidaan käyttää toksiinia. Bakteerikantajien poistamiseksi tulee käyttää antibiootteja, joille kyseinen korynebakteerikanta on erittäin herkkä.
Difterian spesifinen estohoito
Tärkein keino torjua kurkkumätää on väestön massarokotus. Tätä varten käytetään erilaisia rokotevaihtoehtoja, mukaan lukien yhdistelmärokotteita, jotka tähtäävät immuniteetin samanaikaiseen luomiseen useita taudinaiheuttajia vastaan. Venäjällä yleisin rokote on DTP. Se on alumiinihydroksidiin adsorboitu hinkuyskäbakteerisuspensio, joka tapetaan formaliinilla tai timerosaalilla (20 miljardia 1 ml:ssa), ja joka sisältää difteriatoksoidia 30 flokkuloivan yksikön annoksena ja 10 yksikköä tetanustoksoidia sitovaa 1 ml:ssa. Lapset rokotetaan 3 kuukauden iästä alkaen, ja sen jälkeen tehdään uusintarokotukset: ensimmäinen 1,5–2 vuoden iässä, seuraavat 9 ja 16 vuoden iässä ja sen jälkeen 10 vuoden välein.
Neuvostoliitossa vuonna 1959 alkaneen massarokottamisensa ansiosta kurkkumädän ilmaantuvuus maassa vuoteen 1966 mennessä väheni 45 kertaa vuoteen 1958 verrattuna, ja sen luku vuonna 1969 oli 0,7 tapausta 100 000 asukasta kohden. Rokotusmäärien väheneminen 1980-luvulla johti vakaviin seurauksiin. Vuosina 1993–1996 Venäjää pyyhkäisi kurkkumätäepidemia. Aikuiset, pääasiassa rokottamattomat, ja lapset sairastuivat. Vuonna 1994 rekisteröitiin lähes 40 tuhatta potilasta. Tämän yhteydessä massarokotus aloitettiin uudelleen. Tänä aikana rokotettiin 132 miljoonaa ihmistä, joista 92 miljoonaa oli aikuisia. Vuosina 2000–2001 lasten rokotuskattavuus vahvistetussa ajassa oli 96 % ja uusintarokotusten kanssa 94 %. Tästä johtuen kurkkumädän ilmaantuvuus vuonna 2001 laski 15 kertaa vuoteen 1996 verrattuna. Jotta ilmaantuvuus kuitenkin vähenisi yksittäistapauksiin, on välttämätöntä rokottaa vähintään 97–98 % lapsista ensimmäisen elinvuotensa aikana ja varmistaa massarokotus seuraavina vuosina. On epätodennäköistä, että kurkkumätä häviäisi kokonaan tulevina vuosina toksigeenisten ja ei-toksigeenisten difteriabakteerien laajalle levinneen leviämisen vuoksi. Myös tämän ongelman ratkaiseminen vie jonkin aikaa.

