Lääketieteen asiantuntija
Uudet julkaisut
Vaikean sepsiksen ja septisen sokin hoito
Viimeksi tarkistettu: 04.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Sepsiksen tehokas hoito on mahdollista vain infektiokohdan täydellisellä kirurgisella puhdistuksella ja riittävällä mikrobilääkityksellä. Riittämätön alkuvaiheen mikrobilääkehoito on kuoleman riskitekijä sepsispotilailla. Potilaan hengen ylläpitäminen, elintoimintojen häiriöiden ehkäiseminen ja poistaminen ovat mahdollisia vain kohdennetulla tehohoidolla.
Sen päätavoitteena on optimoida happikuljetusta lisääntyneen happikulutuksen olosuhteissa, jotka ovat tyypillisiä vaikealle sepsikselle ja septiselle sokille. Tätä hoitoa toteutetaan hemodynamiikan ja hengitystuen avulla.
Hemodynaaminen tuki
Infuusiohoito
Infuusiohoito on yksi ensimmäisistä toimenpiteistä hemodynamiikan ja ennen kaikkea sydämen minuuttitilavuuden ylläpitämiseksi. Sen päätehtävät sepsispotilailla ovat:
- riittävän kudosperfuusion palauttaminen,
- homeostaasin häiriöiden korjaus,
- solujen aineenvaihdunnan normalisointi,
- septisten kaskadivälittäjien ja myrkyllisten metaboliittien pitoisuuden väheneminen.
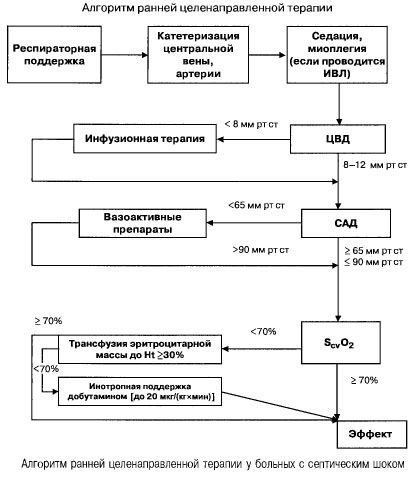
Sepsisissä, joissa on useita elinten vajaatoimintaa ja septinen sokki, he yrittävät saavuttaa nopeasti (ensimmäisten 6 tunnin aikana) seuraavat tärkeiden indikaattoreiden arvot:
- hematokriitti >30 %,
- diureesi 0,5 ml/(kg/h),
- veren saturaatio yläonttolaskimossa tai oikeassa eteisessä >70 %,
- keskimääräinen verenpaine > 65 mmHg,
- Sydänpaine 8–12 mmHg
Näiden arvojen ylläpitäminen määritellyllä tasolla parantaa potilaan eloonjäämistä (todisteiden luokka B). Hemodynamiikan seuranta Swan-Ganz-katetrin ja PICCO-tekniikan (transpulmonaalinen termodiluutio ja pulssiaaltoanalyysi) avulla laajentaa hemodynaamisen hoidon tehokkuuden seuranta- ja arviointimahdollisuuksia, mutta ei ole näyttöä siitä, että ne parantaisivat eloonjäämistä.
Optimaalinen esikuormitusarvo valitaan yksilöllisesti, koska on tarpeen ottaa huomioon endoteelin vaurion aste ja keuhkojen imunesteen virtauksen tila, kammioiden diastolinen toiminta ja rintakehän sisäisen paineen muutokset. Infuusiohoidon tilavuus valitaan siten, että PCWP ei ylitä plasman COP:ta (olemian ehkäisy) ja CO lisääntyy. Lisäksi otetaan huomioon keuhkojen kaasunvaihtotoimintoa kuvaavat parametrit (paO2 ja paO2 / FiO2 ) ja röntgenkuvan muutokset.
Sepsiksen ja septisen shokin kohdennetussa hoidossa infuusiohoidossa käytetään kristalloidi- ja kolloidiliuoksia lähes identtisillä tuloksilla.
Kaikilla infuusionesteillä on sekä etuja että haittoja. Nykyään, kokeellisten ja kliinisten tutkimusten tulosten perusteella, ei ole mitään syytä suosia mitään tiettyä tyyppiä.
- Esimerkiksi laskimopaluiden ja esikuormitustason riittävän korjaamiseksi on tarpeen antaa kristalloideja 2–4 kertaa suurempi tilavuus kuin kolloideja, mikä liittyy liuoksen jakautumisen erityispiirteisiin kehossa. Lisäksi kristalloidi-infuusioon liittyy suurempi kudosödeeman riski, ja niiden hemodynaaminen vaikutus on lyhyempi kuin kolloideilla. Samalla kristalloidit ovat halvempia, eivät vaikuta hyytymispotentiaaliin eivätkä aiheuta anafylaktoidisia reaktioita. Edellä esitetyn perusteella infuusio-ohjelman laadullinen koostumus määritetään potilaan ominaisuuksien perusteella ottaen huomioon hypovolemian aste, DIC-oireyhtymän vaihe, perifeerisen turvotuksen esiintyminen ja albumiinin pitoisuus veressä seerumissa sekä akuutin keuhkovaurion vakavuus.
- Plasman korvikkeet (dekstraanit, gelatiinivalmisteet, hydroksietyylitärkkelys) ovat aiheellisia vaikeassa tyvisolusyövän puutoksessa. Hydroksietyylitärkkelyksillä, joiden substituutioaste on 200/0,5, 130/0,4 ja 130/0,42, on potentiaalinen etu dekstraaneihin verrattuna, koska niillä on pienempi kalvon läpitunkeutumisen riski ja niillä ei ole kliinisesti merkittävää vaikutusta hemostaasiin.
- Albumiinin antaminen kriittisissä olosuhteissa voi lisätä kuolemanriskiä. COP:n nousu infuusion aikana on ohimenevää, ja sitten kapillaarikerroksen läpäisevyyden lisääntyessä ("kapillaarivuoto"-oireyhtymä) albumiinia ekstravasoidaan edelleen. On mahdollista, että albumiinin siirto on hyödyllinen vain, jos sen pitoisuus seerumissa on alle 20 g/l eikä ole merkkejä "vuotosta" interstitiumiin.
- Kryoplasman käyttö on aiheellista kulutuskoagulopatian ja veren hyytymispotentiaalin heikkenemisen hoidossa.
- Luovutettujen punasolujen massan laajamittaista käyttöä tulisi rajoittaa erilaisten komplikaatioiden (APL, anafylaktiset reaktiot jne.) kehittymisen suuren riskin vuoksi. Useimpien asiantuntijoiden mukaan vaikeaa sepsistä sairastavien potilaiden hemoglobiinin vähimmäispitoisuus on 90–100 g/l.
Hypotension korjaus
Alhainen perfuusiopaine vaatii välittömästi sellaisten lääkkeiden aktivointia, jotka lisäävät sydämen verisuonten sävyä ja/tai inotrooppista toimintaa. Dopamiini tai noradrenaliini ovat ensilinjan lääkkeitä hypotension korjaamiseksi septisessä sokissa olevilla potilailla.
Dopamiini (dopmiini) annoksella <10 mikrog/(kg x min) nostaa verenpainetta pääasiassa lisäämällä verenkiertoa, ja sillä on minimaalinen vaikutus systeemiseen verisuonten vastukseen. Suurilla annoksilla sen α-adrenerginen vaikutus on vallitseva, mikä johtaa valtimoiden supistumiseen, ja annoksella <5 mikrog/(kg x min) dopamiini stimuloi munuaisten, suoliliepeen ja sepelvaltimoiden dopaminergisiä reseptoreita, mikä johtaa vasodilataatioon, lisääntyneeseen glomerulaariseen suodatukseen ja Na+-ionien erittymiseen.
Noradrenaliini nostaa keskimääräistä valtimopainetta ja lisää glomerulaarista suodatusta. Systeemisen hemodynamiikan optimointi sen vaikutuksesta johtaa munuaisten toiminnan paranemiseen ilman pienten dopamiiniannosten käyttöä. Viime vuosien tutkimukset ovat osoittaneet, että sen erillinen käyttö verrattuna yhdistelmään suurten dopamiiniannosten kanssa johtaa tilastollisesti merkitsevään kuolleisuuden vähenemiseen.
Adrenaliini on adrenerginen lääke, jolla on voimakkaimmat hemodynaamiset sivuvaikutukset. Sillä on annoksesta riippuva vaikutus sykkeeseen, keskivaltimopaineeseen, sydämen minuuttitilavuuteen, vasemman kammion toimintaan sekä hapen kulkeutumiseen ja kulutukseen . Takyarytmioita, elinten verenkierron heikkenemistä ja hyperlaktatemiaa esiintyy kuitenkin samanaikaisesti. Siksi adrenaliinin käyttö rajoittuu tapauksiin, joissa muut katekoliamiinit eivät tehoa lainkaan.
Dobutamiini on ensisijainen lääke CO:n ja O2:n kulkeutumisen ja kulutuksen lisäämiseen normaalilla tai kohonneella esikuormituksella. Koska se vaikuttaa pääasiassa beeta1-adrenergisiin reseptoreihin, se on dopamiinia tehokkaampi näiden parametrien lisäämisessä.
Kokeelliset tutkimukset ovat osoittaneet, että katekoliamiinit voivat verenkierron tukemisen lisäksi säädellä systeemisen tulehduksen kulkua vaikuttamalla etäisesti keskeisten välittäjäaineiden synteesiin. Adrenaliinin, dopamiinin, noradrenaliinin ja dobutamiinin vaikutuksesta aktivoituneet makrofagit vähentävät TNF-a:n synteesiä ja eritystä.
Adrenergisten aineiden valinta suoritetaan seuraavan algoritmin mukaisesti:
- sydänindeksi 3,5–4 l/(min x m² ), SvO² > 70 % - dopamiini tai noradrenaliini,
- sydänindeksi <3,5 l/(min x m2 ), SvO2 < 70 % - dobutamiini (jos systolinen verenpaine <70 mmHg - yhdessä noradrenaliinin tai dopamiinin kanssa).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Hengityksen tuki
Keuhkot ovat ensimmäisiä kohde-elimiä, jotka osallistuvat sepsiksen patologiseen prosessiin. Akuutti hengitysvajaus on yksi monielinvaurion johtavista tekijöistä. Sen kliiniset ja laboratoriotutkimukset sepsiksessä vastaavat ALI:ta ja patologisen prosessin edetessä ARDS:ää. Mekaanisen ventilaation indikaatiot vaikeassa sepsiksessä määräytyvät parenkymaattisen hengitysvajauksen (ARF tai ARDS) vaikeusasteen mukaan. Sen kriteerinä on hengitysindeksi:
- <200 - trakeaalinen intubaatio ja hengitystuki ovat aiheellisia,
- >200 - lukemat määritetään yksilöllisesti.
Jos potilas on tajuissaan spontaanin hengityksen aikana happituella, hengitystyön kuormitus ei ole suuri eikä takykardia ole voimakasta (syke <120 minuutissa) ja laskimopaluvirtauksen normaaliarvo on SO2 > 90 %, on mahdollista pidättäytyä siirtämisestä ventilaatioon. Potilaan tilaa on kuitenkin seurattava huolellisesti. Optimaalinen SO2-arvo on noin 90 %. Sitä voidaan ylläpitää erilaisilla kaasunantomenetelmillä (kasvomaskit, nenäkatetrit) myrkyttöminä pitoisuuksina (FiO2 < 0,6). Ei-invasiivinen ventilaatio on vasta-aiheinen sepsiksessä (todisteiden kategoria B).
Suuritilavuuksisia mekaanisia ventilaatiomuotoja (MVV) (VO2 = 12 ml/kg) tulisi välttää, koska tällaisissa tapauksissa sytokiinien eritys keuhkoista lisääntyy, mikä johtaa MOF:n pahenemiseen. On välttämätöntä noudattaa turvallisen mekaanisen ventilaation käsitettä, joka on mahdollista, jos seuraavat ehdot täyttyvät (todisteiden luokka A):
- DO <10 ml/kg,
- sisäänhengityksen ja uloshengityksen suhde, joka ei ole käänteinen,
- huippuhengitysteiden paine <35 cm H2O,
- FiO2 < 0,6.
Hengityssyklin parametrien valintaa suoritetaan, kunnes riittävä mekaaninen ventilaatio on saavutettu. Kriteerit ovat paO2 > 60 mmHg, SpO2 > 88–93 %, pvO2 35–45 mmHg ja SvO2 > 55 %.
Yksi tehokkaista menetelmistä kaasujen vaihdon optimoimiseksi on tekohengityksen suorittaminen vatsamakuuasennossa (näyttöluokka B). Tämä asento on tehokas vaikeimmassa tilassa olevilla potilailla, vaikka sen vaikutus kuolleisuuden vähentämiseen pitkällä aikavälillä on tilastollisesti merkityksetön.
Ravitsemuksellinen tuki
Keinotekoisen ravitsemuksen antaminen on tärkeä osa hoitoa, yksi pakollisista toimenpiteistä, koska sepsiksen monielinvaurio-oireyhtymän kehittymiseen liittyy yleensä hypermetabolismin ilmenemismuotoja. Tällaisessa tilanteessa energiantarpeet tyydytetään tuhoamalla omat solurakenteet (autokannibalismi), mikä pahentaa elinten toimintahäiriöitä ja lisää endotoksikoosia.
Ravitsemustukea pidetään keinona ehkäistä vakavaa uupumusta (proteiini-energiavaje) kata- ja aineenvaihdunnan voimakkaan lisääntymisen taustalla. Enteraalisen ravitsemuksen sisällyttäminen tehohoitokompleksiin estää suoliston mikroflooran liikkumisen, dysbakterioosin, lisää enterosyyttien toiminnallista aktiivisuutta ja suoliston limakalvon suojaavia ominaisuuksia. Nämä tekijät vähentävät endotoksikoosin astetta ja toissijaisten infektiokomplikaatioiden riskiä.
Ravitsemuksellisen tuen laskeminen:
- energia-arvo - 25-35 kcal/(kg ruumiinpainoa x päivä),
- proteiinin määrä - 1,3–2,0 g/(kg ruumiinpainoa x päivä),
- hiilihydraattien (glukoosi) määrä - alle 6 g/kg/vrk,
- rasvan määrä - 0,5–1 g/kg/vrk,
- glutamiinidipeptidit 0,3–0,4 g/kg/vrk,
- vitamiinit - normaali päivittäinen annoskoko + K-vitamiini (10 mg/vrk) + B1- ja B6 vitamiinit (100 mg/vrk) + A-, C- ja E-vitamiinit
- hivenaineet - normaali vuorokausiannos + sinkki (15-20 mg/vrk + 10 mg/vrk löysän ulosteen yhteydessä),
- elektrolyytit - Na+, K+, Ca2+ tasapainolaskelmien ja plasman pitoisuuden mukaan.
Ravitsemustuen varhainen aloittaminen (24–36 h) on tehokkaampaa kuin intensiivihoidon 3.–4. päivänä (todisteiden luokka B), erityisesti enteraalisessa letkuravitsemuksessa.
Vaikeassa sepsiksessä enteraalisella tai parenteraalisella ravitsemuksella ei ole etuja; elinten toimintahäiriöiden kesto ja hengitys- ja inotrooppisen tuen kesto ovat samat, ja kuolleisuusluvut ovat samat. Edellä esitetyn perusteella varhainen enteraalinen ravitsemus on halvempi vaihtoehto parenteraaliselle ravitsemukselle. Ravintokuidulla (prebiooteilla) rikastettujen seosten käyttö letkuravitsemuksessa vähentää merkittävästi ripulin esiintyvyyttä vaikeaa sepsistä sairastavilla potilailla.
Tehokkaan proteiinisynteesin kannalta kehossa on tärkeää ylläpitää metabolinen suhde "kokonaistyppi, g - ei-proteiinikalorit, kcal" = 1-(110-130). Hiilihydraattien enimmäisannos on 6 g / (kg ruumiinpainoa päivässä), koska suurten annosten käyttöönotto uhkaa hyperglykemiaa ja katabolian aktivoitumista luustolihaksissa. Rasvaemulsioita suositellaan annettavaksi ympäri vuorokauden.
Ravintotuen vasta-aiheet:
- dekompensoitunut metabolinen asidoosi,
- yksilöllinen intoleranssi ravintolisiä varten,
- vaikea toipumaton hypovolemia,
- hoitoresistentti sokki - dopamiiniannos >15 mikrog/(kg x min) ja systolinen verenpaine <90 mmHg,
- vaikea, hoitamaton valtimohypoksemia.
Glykeeminen hallinta
Tärkeä osa vaikean sepsiksen monimutkaista hoitoa on verensokeripitoisuuden jatkuva seuranta ja insuliinihoito. Korkea glykemia ja sen korjaamisen tarve ovat sepsiksen epäsuotuisan lopputuloksen tekijöitä. Edellä mainitut olosuhteet huomioon ottaen potilailla ylläpidetään normoglykemiaa (4,5–6,1 mmol/l), ja kun glukoosipitoisuus nousee hyväksyttävien arvojen yläpuolelle, suoritetaan insuliini-infuusio (0,5–1 U/h). Kliinisestä tilanteesta riippuen glukoosipitoisuutta seurataan 1–4 tunnin välein. Tätä algoritmia toteutettaessa havaittiin tilastollisesti merkitsevä potilaiden eloonjäämisen kasvu.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glukokortikoidit
Nykyaikaisten tutkimusten tulokset glukokortikoidien käytön tehokkuudesta septistä sokkia sairastavilla potilailla on tiivistetty seuraaviin väitteisiin:
- Hormonien käyttö suurina annoksina ei ole tarkoituksenmukaista [metyyliprednisoloni 30–120 mg/(kg x vrk) kerran tai 9 päivän ajan, deksametasoni 2 mg/(kg x vrk) 2 päivän ajan, betametasoni 1 mg/(kg x vrk) 3 päivän ajan] - sairaalainfektioiden riski kasvaa, ei vaikutusta eloonjäämiseen
- Hydrokortisonin käyttö annoksella 240–300 mg päivässä 5–7 päivän ajan nopeuttaa hemodynaamisten parametrien vakautumista, mahdollistaa verisuonituen lopettamisen ja parantaa eloonjäämistä potilailla, joilla on samanaikainen suhteellinen lisämunuaisten vajaatoiminta (todisteiden luokka B).
Prednisolonin ja deksametasonin kaoottisesta empiirisestä määräämisestä on luovuttava – niihin ei ole perusteita ekstrapoloida uutta tietoa. Laboratoriossa ei ole näyttöä suhteellisesta lisämunuaisten vajaatoiminnasta, hydrokortisonia annetaan 300 mg:n vuorokausiannoksella (3–6 injektiona).
- refraktaarisessa sokissa
- jos tehokkaan hemodynamiikan ylläpitämiseksi tarvitaan suuria vasopressoriannoksia.
On mahdollista, että septisen sokin systeemisen tulehduksen olosuhteissa hydrokortisonin teho liittyy tumatekijä kB:n estäjän (NF-kB-a) aktivoitumiseen ja suhteellisen lisämunuaisten vajaatoiminnan korjaantumiseen. Transkriptionaalisen tumatekijän (NF-kB) aktiivisuuden esto puolestaan johtaa indusoituvan NO-syntetaasin (NO on tehokkain endogeeninen vasodilataattori), tulehdusta edistävien sytokiinien, COX:n ja adheesiomolekyylien muodostumisen vähenemiseen.
Aktivoitu proteiini C
Yksi sepsiksen tyypillisistä ilmenemismuodoista on systeemisen hyytymisen häiriintyminen (hyytymiskaskadin aktivoituminen ja fibrinolyysin estyminen), mikä lopulta johtaa hypoperfuusioon ja elinten toimintahäiriöihin. Aktivoituneen proteiini C:n vaikutus tulehdusjärjestelmään toteutuu useilla tavoilla:
- selektiinin kiinnittymisen väheneminen leukosyytteihin, mikä suojaa endoteelia vaurioilta ja on avainasemassa systeemisen tulehduksen kehittymisessä,
- monosyyttien sytokiinien vapautumisen väheneminen,
- estämällä TNF-a:n vapautumista leukosyyteistä,
- trombiinin tuotannon esto (se voimistaa tulehdusvastetta).
Antikoagulantti, profibrinolyyttinen ja tulehdusta estävä vaikutus
- aktivoitunut proteiini C johtuu
- tekijöiden Va ja VIIIa hajoaminen - trombin muodostumisen estäminen,
- plasminogeeniaktivaattorin estäjän suppressio - fibrinolyysin aktivaatio,
- suora tulehdusta estävä vaikutus endoteelisoluihin ja neutrofiileihin,
- endoteelin suojaaminen apoptoosilta
Aktivoituneen proteiini C:n [drotrekogiini alfa (aktivoitu)] anto annoksella 24 mikrog/(kg/h) 96 tunnin ajan vähentää kuolemanriskiä 19,4 %. Antoaiheet: sepsis, johon liittyy akuutti MOF ja suuri kuolemanriski (APACHE II > 25 pistettä, kahden tai useamman elimen toimintahäiriö, näyttöluokka B).
Aktivoitu proteiini C ei vähennä kuolleisuutta lapsilla, potilailla, joilla on yhden elimen toimintahäiriö, APACHE II < 25 pistettä, eikä potilailla, joilla on ei-kirurginen sepsis.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Immunoglobuliinit
Immunoglobuliinien (IgG ja IgG+IgM) laskimonsisäisen annon tarkoituksenmukaisuus liittyy niiden kykyyn rajoittaa tulehdusta edistävien sytokiinien liiallista toimintaa, lisätä endotoksiinien ja stafylokokki-superantigeenin puhdistumaa, poistaa anergiaa ja tehostaa beetalaktaamiantibioottien vaikutusta. Niiden käyttö vaikean sepsiksen ja septisen sokin hoidossa on ainoa immunokorrektiomenetelmä, joka lisää eloonjäämisastetta. Paras vaikutus kirjattiin käytettäessä IgG:n ja IgM:n yhdistelmää [RR = 0,48 (0,35–0,75), näyttöluokka A]. Vakioannosteluohjelma on 3–5 ml/(kg x vrk) kolmena päivänä peräkkäin. Immunoglobuliineja käytettäessä optimaalisimmat tulokset saatiin shokin varhaisvaiheessa ("lämmin sokki") ja potilailla, joilla oli vaikea sepsis (APACHE II -pistemäärä 20–25 pistettä).
Syvän laskimotromboosin ehkäisy
Alaraajojen syvän laskimotukoksen ehkäisy vaikuttaa merkittävästi sepsispotilaiden hoitotuloksiin (todisteiden luokka A). Tähän tarkoitukseen käytetään sekä fraktioimatonta että LMWH:ta. Pienimolekyylipainoisten hepariinien tärkeimmät edut ovat verenvuotokomplikaatioiden vähäisempi esiintyvyys, heikompi vaikutus verihiutaleiden toimintaan ja pitkäkestoinen vaikutus (voidaan antaa kerran päivässä).
Ruoansulatuskanavan stressihaavojen muodostumisen ehkäisy
Tällä hoitosuunnassa on merkittävä rooli vaikeaa sepsistä ja septistä sokkia sairastavien potilaiden hoidon suotuisassa tuloksessa, sillä ruoansulatuskanavan stressihaavojen aiheuttaman verenvuodon kuolleisuus on 64–87 %. Ilman ennaltaehkäiseviä toimenpiteitä stressihaavoja esiintyy 52,8 %:lla kriittisesti sairaista potilaista. Protonipumpun estäjien ja histamiini H2 -reseptorin salpaajien käyttö kuitenkin vähentää riskiä yli kaksinkertaisesti (ensimmäinen lääkeryhmä on tehokkaampi kuin toinen). Ehkäisyn ja hoidon pääasiallinen suunta on pH:n ylläpitäminen 3,5–6,0:ssa. On korostettava, että edellä mainittujen lääkkeiden lisäksi enteraalisella ravitsemuksella on tärkeä rooli stressihaavojen muodostumisen ehkäisyssä.
Kehonulkoinen verenpuhdistus
Useat yleistyneen tulehduksen kehittymiseen osallistuvat biologisesti aktiiviset aineet ja aineenvaihduntatuotteet ovat vieroitusmenetelmien kohteita, mikä on erityisen tärkeää luonnollisen maksa- ja munuaispuhdistuman puuttuessa monielinvauriotilanteissa. Munuaisten korvaushoitomenetelmiä pidetään lupaavina, koska ne voivat vaikuttaa paitsi munuaisten vajaatoimintaa sairastavien potilaiden ureemisiin häiriöihin, myös muihin homeostaasin muutoksiin ja elintoimintojen toimintahäiriöihin, joita esiintyy sepsiksessä, sokissa ja monielinvauriossa.
Tähän mennessä ei ole olemassa tietoa, joka vahvistaisi tarpeen käyttää kehonulkoisia verenpuhdistusmenetelmiä yhtenä sepsiksen ja septisen shokin patogeneettisen hoidon pääsuunnista. Niiden käyttö on perusteltua munuaisten hallitsevan useiden elinten vajaatoiminnan yhteydessä.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialyysi
Menetelmän ydin on pienimolekyylipainoisten aineiden (jopa 5x103 Da ) diffuusio puoliläpäisevän kalvon läpi ja ylimääräisen nesteen poistaminen kehosta painegradienttia pitkin. Hemodialyysiä käytetään laajalti sekä kroonisen että akuutin munuaisten vajaatoiminnan hoitoon. Aineiden diffuusionopeus riippuu eksponentiaalisesti niiden molekyylipainosta. Esimerkiksi oligopeptidien poistuminen on hitaampaa kuin niiden synteesi.
Hemofiltraatio
Hemofiltraatio on tehokas menetelmä molekyylipainoltaan 5x103 - 5x104 Da olevien aineiden poistamiseen ja ainoa tapa poistaa elimistöstä suuri joukko biologisesti aktiivisia aineita ja metaboliitteja. Menetelmä perustuu massansiirtoon perustuvaan konvektiomenetelmään. Atsotemian riittävän korjauksen lisäksi hemofiltraatio poistaa tehokkaasti anafylaktoksiinit C3a, C5a, tulehdusta edistävät sytokiinit (TNF-α, IL-1b, 6 ja 8), ß2-mikroglobuliini, myoglobiini, lisäkilpirauhashormoni, lysotsyymi (molekyylipaino - 6000 Da), α-amylaasi (molekyylipaino - 36 000 - 51 000 Da), kreatiinifosfokinaasin, alkalisen fosfataasin, transaminaasit ja muut aineet. Hemofiltraatio poistaa aminohappoja ja plasmaproteiineja (mukaan lukien immunoglobuliinit ja verenkierrossa olevat immuunikompleksit).
Hemodiafiltraatio
Hemodiafiltraatio on tehokkain verenpuhdistusmenetelmä, jossa yhdistyvät diffuusio ja konvektio (eli GD ja GF). Lisäksi vieroitusprosessiin vaikuttaa patologisten aineiden sorptio suodatinkalvoon.
Plasmafereesi
Plasmafereesiä (plasmanvaihto, plasman filtraatio) pidetään myös mahdollisena menetelmänä yleistyneen tulehduksen korjaamiseksi sepsis- ja septisishokkipotilailla. Optimaalisena menetelmänä pidetään plasmanvaihtoa jatkuvassa tilassa, jossa poistetaan 3-5 tilavuusosaa plasmaa ja se korvataan samanaikaisesti tuoreella jäädytetyllä albumiini-, kolloidi- ja kristalloidiliuoksella. Seulontakertoimella 1 plasman suodatus varmistaa C-reaktiivisen proteiinin, haptoglobiinin, komplementtifragmentin C3, 1-antitrypsiinin, IL-6:n, tromboksaani-B2:n, granulosyyttejä stimuloivan tekijän ja TNF:n hyvän poiston. Sorbenttien käyttö potilaan plasman puhdistamiseen vähentää infektioriskiä ja alentaa toimenpiteen kustannuksia, koska vieraita proteiineja ei tarvitse käyttää.
Pitkäaikainen natriumseleniitin (selenaasi) infuusio annoksella 1000 mikrog/vrk vaikeassa sepsiksessä johtaa kuolleisuuden vähenemiseen.
Seleeni on välttämätön hivenaine, jonka merkitys liittyy sen keskeiseen rooliin solujen antioksidanttijärjestelmissä. Veren seleenipitoisuus pysyy 1,9–3,17 μM/l:ssa. Seleenin tarve on 50–200 μg päivässä, ja se riippuu muiden antioksidanttien ja hivenaineiden saatavuudesta.
Seleeni on voimakas antioksidantti, joka on osa glutationiperoksidaasia, fosfoliiniglutationiperoksidaasia, muita oksidoreduktaaseja ja joitakin transferaaseja. Glutationiperoksidaasi on tärkein lenkki endogeenisessä antioksidanttijärjestelmässä.
Seleenin tehokkuutta kriittisissä olosuhteissa on tutkittu viime vuosina. Nämä tutkimukset ovat osoittaneet, että seleenin tärkeimmät vaikutusmekanismit ovat:
- NF-kB:n hyperaktivaation tukahduttaminen;
- komplementin aktivaation väheneminen;
- sen toiminta immunomodulaattorina, antioksidanttina ja tulehdusta estävänä aineena
- peroksidin käytön ylläpitäminen;
- endoteelin adheesion heikkeneminen (ICAM-1:n, VCAM-2:n ilmentymisen väheneminen,
- E - selektiini, P - selektiini);
- endoteelin suojaaminen oksiradikaaleilta (selenoproteiini P:n avulla, joka estää peroksinitriitin muodostumisen O2:sta ja NO:sta).
Yhteenvetona edellä esitetystä voimme määritellä tehohoidon erityistehtävät vaikeassa sepsiksessä:
- Hemodynaaminen tuki: keskushermostopaine 8–12 mmHg, keskiverenpaine > 65 mmHg, diureesi 0,5 ml/(kg/h), hematokriitti > 30 %, sekalaskimoveren saturaatio > 70 %.
- Hengityksen tuen huippupaine hengitysteissä <35 cm H2O, sisäänhengityksen happiosuus <60 %, vuorovesitilavuus <10 ml/kg, sisäänhengityksen ja uloshengityksen suhde ei-käänteinen.
- Glukokortikoidit - "pienet annokset" (hydrokortisoni 240-300 mg päivässä).
- Aktivoitua proteiinia C 24 mikrog/(kg/h) 4 päivän ajan vaikeassa sepsiksessä (APACHE II >25).
- Immunokorrektiokorvaushoito pentaglobiinilla.
- Alaraajojen syvän laskimotromboosin ehkäisy.
- Ruoansulatuskanavan stressihaavojen muodostumisen ehkäisy: protonipumpun estäjien ja H2-histamiinireseptorien salpaajien käyttö.
- Korvaushoito akuuttiin munuaisten vajaatoimintaan.
- Ravitsemuksellinen tuki: ruoan energia-arvo 25–30 kcal/kg ruumiinpainoa x vrk), proteiini 1,3–2,0 g/(kg ruumiinpainoa x vrk), glutamiinidipeptidit 0,3–0,4 g/(kg x vrk), glukoosi - 30–70 % proteiinittomista kaloreista, edellyttäen, että glykemia pysyy < 6,1 mmol/l, rasvat - 15–50 % proteiinittomista kaloreista.

