Lääketieteen asiantuntija
Uudet julkaisut
Lääkehoito
Tromboosia ehkäisevät ja veren reologiaa parantavat lääkkeet
Viimeksi tarkistettu: 07.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Useiden mikrotrombien muodostumisen estämisessä sokin aikana ja niiden tuhoutumisessa voidaan käyttää erilaisia farmakologisia lähestymistapoja, joissa käytetään lääkkeitä, jotka estävät trombin muodostumista ja parantavat veren reologiaa:
- systeemisten hemodynaamisten ja mikrokiertohäiriöiden poistaminen vasoaktiivisilla ja inotrooppisilla aineilla;
- toimenpiteet veren reologian parantamiseksi käyttämällä rationaalista infuusiohoitoa ja lääkkeitä, jotka palauttavat punasolujen kalvojen elastisuuden (trental tai pentoksifylliini);
- verihiutaleiden aggregaation estäminen ja alkuvaiheen "valkoisten" trombien muodostuminen pienissä valtimoissa, minkä jälkeen hyytymiskaskadin käynnistyminen;
- trombin muodostumisen esto systeemisen hyytymiskaskadin aktivaation jälkeen;
- fibrinolyysin aktivointi tarkoituksena liuottaa vasta muodostuneita verihyytymiä (fibrinolysiini, streptokinaasi, streptodekaasi, urokinaasi jne.) tai päinvastoin fibrinolyysin esto, kun se yleistyy joillakin traumaattista sokkia ja sepsistä sairastavilla potilailla (aminokapronihappo, ambene, kontrakali jne.).
Useimmat luetelluista lähestymistavoista ovat perinteisiä, hyvin kehittyneitä shokin hoidon käytännössä, niillä on omat hemoreologiset käyttöaiheensa ja ne on määritelty asiaankuuluvissa luvuissa. Siksi tässä osiossa on suositeltavaa keskittyä yleiseen lähestymistapaan trombin muodostumisen ehkäisemiseksi shokissa käyttämällä farmakologisia aineita, jotka vaikuttavat veren hyytymisen profaasiin. Juuri tämä hyytymiskomplikaatioiden ehkäisytaso - "valkoisten valtimotrombien" esiintyminen, muodostuminen ja kasvu - herättää tutkijoiden suurimman huomion.
Erilaisille sokkityypeille on tyypillistä erilaiset ja usein monisuuntaiset veren hyytymishäiriöt, joihin liittyy veren reologian heikkeneminen. Septisille, endotoksiini-, palovamma-, traumaattisille ja hemorragisille sokkityypeille tyypillisin ilmiö on useiden mikrotrombien muodostuminen pienimpiin verisuoniin. Tämä johtuu systeemisen hemodynamiikan häiriöistä, vasospasmista ja mikrokiertohäiriöistä, veren paksuuntumisesta, sakkautumisesta, punasolukalvojen elastisuuden vähenemisestä sekä lukuisista yleisistä ja paikallisista tekijöistä (autokoidit), jotka käynnistävät paikallisia muutoksia hyytymishemostaasissa ja veren hyytymisprofaasin aktivoitumisessa.
Kaaviomuodossa (lyhennettynä) hemokoagulaation alkuvaihe ja paikallisen hemokoagulaation homeostaasin mekanismi esitetään seuraavasti.
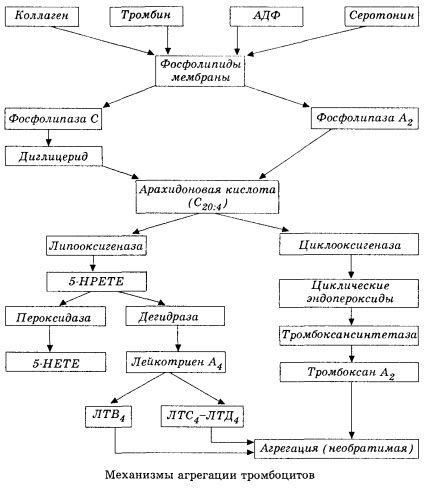
Se alkaa kalvofosfolipaasi A2:n aktivoitumisesta useiden vahingollisten tekijöiden (suora kalvovaurio, hypoksia, lipidiperoksidaatio, endogeenisten kemiallisten tekijöiden vaikutus jne.) yhdistelmän vaikutuksesta. Kalvofosfolipidien hajoamisen seurauksena vapautuu esteröimättömiä pitkäketjuisia rasvahappoja, joista arakidonihappo on tärkein lähtöaineena. Sen transformaatio (arakidonihappokaskadi) tapahtuu lipoksigenaasi- (leukotrieenien synteesi) ja syklo-oksigenaasi- (prostaglandiinien, tromboksaanien, prostasykliinin synteesi) reittien kautta.
Tuloksena olevat leukotrieenit (B4, C4, E4, D4 jne.) - erittäin korkean biologisen aktiivisuuden omaavat aineet, joihin kuuluu hitaasti reagoiva anafylaksian aine - ovat erittäin tärkeitä paikallisten verisuoni-, tulehdus- ja immuunireaktioiden, mukaan lukien autoimmuuniprosessien, käynnistymisessä. Leukotrieenit aiheuttavat mikroverenkiertohäiriöitä, lisääntynyttä veren hyytymistä, autolyyttisten lysosomaalisten entsyymien vapautumista ja sydänlihaksen supistuvuutta ja keuhkoputkien kouristuksia estävän tekijän vapautumista vereen.
Koska leukotrieenit kykenevät aiheuttamaan sileän lihaksen supistumista, ne vaikuttavat merkittävästi systeemiseen hemodynamiikkaan, sepelvaltimoihin ja sydänlihakseen, aiheuttaen voimakkaan sepelvaltimoiden supistajan ja negatiivisen inotrooppisen vaikutuksen, johon liittyy sydämen minuuttitilavuuden lasku ja jolla on tärkeä rooli hypotension kehittymisessä.
Sydämen minuuttitilavuuden pieneneminen ja verenpainetta alentava vaste leukotrieeneille liittyvät sydänlihaksen heikkenemiseen ja laskimopalulun rajoittumiseen sydämeen. Merkittävä merkitys laskimopalulun rajoittamisessa on leukotrieenien kyvyllä lisätä verisuonen seinämän läpäisevyyttä ja aiheuttaa plasman ekstravasaatiota. Leukotrieeneillä katsotaan olevan tärkeä rooli sydäninfarktin patogeneesissä.
Anafylaktisessa ja septisessä (endotoksiini) sokissa niiden rooli ilmeisesti kasvaa entisestään, mistä on osoituksena leukotrieenien kyky kertyä merkittäviä määriä plasmaan allergisten reaktioiden aikana ja aiheuttaa anafylaktiselle sokille ominaisia muutoksia systeemisessä verenkierrossa, sekä leukotrieenireseptorien salpaajien ja lipoksigenaasin estäjien suojaavat vaikutukset. Selektiivisten leukotrieenireseptorien salpaajien kehittäminen on melko intensiivistä ja on lupaava tieteen suunta. Tällä alueella on jo saavutettu jonkin verran menestystä, ja tällaisten salpaajien tehokkuus sydänlihaksen iskemiassa, endotoksiinissa ja verenvuotoisessa sokissa on kokeellisesti vahvistettu. Tämän suunnan kliininen käyttöönotto todennäköisesti kuitenkin kestää vielä useita vuosia.
Jos laskimoissa trombeja muodostuu trombosyyttien ja plasman hyytymistekijöiden yhtä suuressa osallistumisessa, niin valtimoissa trombosyytit ovat prosessin pääasiallisia käynnistäjiä. Ne sisältävät ADP:tä, Ca2+:aa, serotoniinia, fosfolipidejä, prostaglandiinisynteesientsyymejä, trombosteniinia (kuten lihasaktomyosiini varmistaa näiden solujen supistumiskyvyn), verisuonen seinämän epiteelin ja lihassolujen trombogeenista kasvutekijää ja useita muita aineita. Trombosyyttien toiminnan humoraalinen säätely tapahtuu niiden kalvojen erikoistuneiden reseptorien kautta (alfa2- ja beeta2-adrenoreseptorit, histamiini- ja serotoniinireseptorit, asetyylikoliini, tromboksaani, adenosiini ja monet muut). Trombosyyttien erityisominaisuus on korkea affiniteetti kollageeniin ja muihin verisuonen seinämän subendoteelisiin osiin sekä kostumattomiin ja negatiivisesti varautuneisiin pintoihin. Tämä ominaisuus antaa trombosyyteille poikkeuksellisen kyvyn tarttua (tarttua) vaurioituneen endoteelin omaavaan verisuonen osaan, jolla on suuri mahdollisuus vaurioitua shokin aikana. Tässä tapauksessa trombosyytit leviävät ja vapauttavat pseudopodioita, jotka voivat tarttua toisiinsa ja verisuonen seinämään. Kalvon läpäisevyys kasvaa, ja trombosyyteistä vapautuu ADP:tä, serotoniinia, tromboksaania ja joitakin trombosyytin pinnalle adsorboittuneita hyytymistekijöitä. Nämä aineet ovat vuorovaikutuksessa vastaavien kalvon reseptorien kanssa ja kalsiumionien osallistuessa aiheuttavat aggregaatiota (aluksi palautuvaa). Prosessista tulee itsestään kestävä, mitä humoraaliset säätelytekijät edistävät; muut tekijät voivat sitä vastoin pysäyttää sen ja jopa kääntää sen päinvastaiseksi aiheuttaen disaggregaatiota.
Trombia muodostavien vaikutusten ja olosuhteiden vallitsevuuden myötä adheesio- ja palautuvat aggregaatiovaiheet korvautuvat kolmannella vaiheella - palautumattomalla aggregaatiolla, joka suoritetaan trombosteniinin osallistuessa ja johtaa hyytymän supistumiseen; aggregaatin vahvistumisen ja supistumisen reaktio tapahtuu myös Ca +:n ja ATP:n osallistuessa ja johtaa valkoisen trombin muodostumiseen.
Arakidonihapon muuntuminen verihiutaleissa, verisuonten endoteelisoluissa ja muissa kudoksissa tapahtuu syklo-oksigenaasireitillä, joka varmistaa paikallisen (metaboliittien puoliintumisaika on hyvin lyhyt) hyytymishomeostaasin, koska tämän aineenvaihdunnan aikana muodostuu voimakkaita pro- ja antiaggregantteja. Syklo-oksigenaasireaktioketjussa verihiutaleiden aggregaatiota aktivoiva pääasiallinen tekijä on tromboksaani A2, ja sen yhtä voimakas antagonisti on endoteelisolujen tuottama prostasykliini ja vähäisemmässä määrin E- ja G-sarjan prostaglandiinit. Lopuksi verihiutaleiden aggregaatioon vaikuttavat voimakkaasti myös muut paikalliset ja systeemiset humoraaliset tekijät.
Verihiutaleiden aggregaation aktivaattorit ja estäjät
Verihiutaleiden aggregaation initiaattorit ja aktivaattorit |
Verihiutaleiden aggregaation estäjät |
Kollageeni |
- |
ADP |
Adenosiini ja sen stabilointiaineet |
Noradrenaliini (alfa2-reseptorien kautta) |
Alfa-adrenergisiä reseptoreita salpaavat aineet |
Serotoniini |
Antiserotoniiniaineet |
Histamiini |
Antihistamiinit |
Trombiini |
Hepariini |
Ca2+ |
Ca2+-antagonistit |
CGMP - sen indusoijat (asetyylikoliini?) ja stabiloijat |
CAM - sen indusoijat (beeta-adrenergisten reseptorien kautta) ja stabiloijat (fosfodiesteraasin estäjät) |
Arakidonihappo |
Dekstraanit, albumiini |
Tromboksaani A2 |
Prostasykliini I2 |
Farmakologiset interventiot trombin muodostumisen alkuvaiheessa sokissa ja akuuteissa iskeemisissä prosesseissa sydämessä ja aivoissa viittaavat seuraavaan mahdollisuuteen:
- arakidonihappokaskadin alkureaktioiden (kokonais- ja osittaisten) esto;
- tromboksaanin synteesin tietyn reaktion esto;
- leukotrieenien ja tromboksaanien reseptorien salpaus verihiutaleissa, sileissä lihaksissa ja muissa soluissa;
- verihiutaleiden aggregaatiota moduloivien aineiden käyttö eli heikentävät muilla tavoin jälkimmäisen reaktiota aloittavien tekijöiden (kollageeni, tromboksaani A2, leukotrieenit jne.) vaikutukseen.
Näiden veren reologisten ominaisuuksien häiriöiden korjausmenetelmien toteuttaminen ratkaisee tärkeimmän taktisen tehtävän: suojata verihiutaleiden aggregaatio- ja adheesioreseptoreita aktivaattoreiden vaikutukselta tai tukahduttaa näiden reseptorien solunsisäiset synteesimekanismit. Arakidonihappokaskadin alkureaktioiden esto voidaan saavuttaa suojaamalla polymeeriaktivaattoreihin reagoivia verihiutaleiden reseptoreita käyttämällä pienimolekyylisiä dekstraaneja, joiden molekyylit kilpailevat fibriinin, kollageenin, aggregoituneen immunoglobuliinin (IgE) ja komplementtijärjestelmän komponenttien kanssa.
Peittäen verihiutaleiden kalvon reseptoreita ja kilpailemalla punasolujen pinnalla olevien suurikokoisten proteiinien kanssa, pienimolekyyliset dekstraanit syrjäyttävät ne ja tuhoavat solujen väliset sillat. Tämä johtuu siitä, että verisuonten endoteeliä ja verisolujen pintaa ympäröivät dekstraanit lisäävät niiden negatiivista varausta, mikä parantaa niiden aggregaatiota estäviä ominaisuuksia.
Dextrans
Pienimolekyylipainoiset dekstraanit vähentävät kollageenin ja ADP:n aiheuttamaa verihiutaleiden aggregaatiota sekä trombiinin aktivoivaa vaikutusta verihiutaleisiin, estävät alkuperäisen valkoisen verihiutaletrombin kasvua, parantavat verenkiertoa, vähentävät plasman fibrinogeenipitoisuuden leikkauksen jälkeistä nousua sekä muuttavat fibriinin rakennetta ja stabiiliutta.
Traumassa ja sokissa annettavat dekstraanien laskimoinfuusiot eivät ainoastaan vähennä verihiutaleiden aggregaatiota ja adheesiota, vaan myös mobilisoivat endogeenistä hepariinia, mikä edistää löysän ja vaikeasti sisäänvedettävän verihyytymän muodostumista, jonka fibrinolyyttiset aineet hajottavat helposti. Pienimolekyylisten dekstraanien antitrombiiniaktiivisuus liittyy niiden spesifiseen vaikutukseen veren hyytymistekijä VIII:n rakenteeseen ja toimintaan. Tekijä VIII (antihemofiilinen globuliini), suuri molekyyli, jolla on monimutkainen rakenne ja toiminta, osallistuu verihiutaleiden aggregaatioon ja syntyvän hyytymän pysyvyyteen. Dekstraanit häiritsevät tekijä VIII:n toimintaa, mikä hidastaa verihiutaleiden aggregaatiota ja vähentää hyytymän pysyvyyttä.
Pienimolekyylipainoiset dekstraanit eivät ole todellisia antikoagulantteja, ja niiden korjaava vaikutus hemoreologisissa häiriöissä liittyy pääasiassa hemodiluutioon, verenkierrossa olevan plasman tilavuuden täydentämiseen ja verenkierron paranemiseen mikroverenkiertojärjestelmässä.
Dekstraanien kyky parantaa verenkiertoa hemodynaamisissa häiriöissä (sokki, verenhukka) johtuu useiden tekijöiden kokonaisuudesta. Polymeerin korkea ohimenevä pitoisuus veressä ei ainoastaan johda "suoraan hemodiluutioon", vaan myös luo olosuhteet nesteen virtaukselle verenkiertoon kudostilasta ja sitä seuraavalle dekstraanin osmoottisen vaikutuksen tasapainottumiselle. Hemodiluution seurauksena veren viskositeetti pienenee, laskimoiden virtaus sydämeen kasvaa ja sydämen minuuttitilavuus kasvaa. Näiden vaikutusten ohella dekstraanit muodostavat komplekseja fibrinogeenin kanssa ja niillä on lipidien muodostumista estävä vaikutus.
Näin ollen pienimolekyylisten dekstraanien aggregaatiota estävä vaikutus ja hemodynaamiset vaikutukset auttavat vähentämään veren viskositeettia, mikä on erityisen tärkeää pienillä leikkausnopeuksilla. Verisolujen hajoaminen parantaa systeemistä verenvirtausta ja mikrokiertoa, erityisesti sen laskimoosassa, jossa nopeusgradienttit ovat pienimmät. Pienimolekyylisten dekstraaniliuosten käyttö erityyppisissä sokeissa, vammojen ja niiden seurausten kirurgisessa hoidossa ja sitten leikkauksen jälkeisenä aikana auttaa ehkäisemään hyperkoagulaatiota ja vähentämään tromboottisten prosessien ja embolian todennäköisyyttä.
On kuitenkin huomattava, että joissakin tapauksissa dekstraaniliuosten infuusioihin liittyy anafylaktisia ja allergisia reaktioita (vaarallisia herkistymisen ja anafylaktisen shokin yhteydessä). Tämä johtuu siitä, että dekstraanit, joilla on suuri molekyylipaino ja useita sivuketjuja, voivat toimia antigeeninä. Siksi yksilöllisen herkkyyden määrittämiseksi on suositeltavaa antaa laskimoon enintään 20 ml pienimolekyylistä dekstraaniliuosta hapteenina (15 % liuos, molekyylipaino 1000) ja suorittaa plasman korvikkeen infuusiot ennen anestesian aloittamista.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Trombiinin estäjät
Verihiutaleiden aktivaattoreiden kanssa vuorovaikutuksessa olevien verihiutaleiden reseptorien farmakologinen suojaus voidaan saavuttaa myös käyttämällä aineita, jotka kilpailevat ei-polymeeristen verihiutaleiden aktivaattoreiden kanssa tai estävät niitä. Tällaisia aineita ovat trombiinin estäjät (hepariini ja hirudiini, useat synteettiset estäjät, adrenaliiniantagonistit), alfa-reseptorien salpaajat (fentolamiini, dihydroergotamiini), ADP-antagonistit (dipyridamoli, adenosiini ja sen rakenneanalogit, fosfokreatiini), serotoniinin antagonistit (metysergidi). Vain muutamia luetelluista aineista käytetään itse asiassa eri syistä johtuvan sokin ehkäisyyn ja hoitoon.
Verihiutaleiden aggregaation ja adheesion aktivaattoreiden kanssa reagoivien proteiinireseptorien solunsisäisten synteesimekanismien suojaaminen ja tromboksaanin synteesiprosessien estäminen ovat mahdollisia eri ryhmien lääkkeillä:
- cATP:n, prostasykliinin ja prostaglandiini PgE2:n indusoijat ja stabiloijat;
- fosfolipaasin ja fosfodiesteraasin estäjät.
Erityisten verihiutaleiden vastaisten aineiden intensiivinen kehitys alkoi suhteellisen äskettäin, eikä se ole vielä johtanut luotettaviin tuloksiin. Tällä hetkellä kliinisessä käytännössä käytetään dekstraaniliuosten lisäksi laajalti sellaisia verihiutaleiden vastaisia aineita kuin asetyylisalisyylihappo, indometasiini, dipyradamoli, sulfiinipyratsoni (persantiini), prostasykliini (eikoprostenoni) ja hepariini estämään valkoisten verihiutaleiden trombien muodostumista.
Ei-steroidiset tulehduskipulääkkeet
On todettu, että tulehduskipulääkkeiden (NSAID) – asetyylisalisyylihapon ja indometasiinin – farmakologiset vaikutukset johtuvat niiden vaikutuksesta eikosanoidien (tromboksaanien ja prostaglandiinien) metaboliaan. Lähes kaikki tämän ryhmän lääkkeet estävät prostaglandiinisyntetaasi-nimistä entsyymikompleksia, jolloin niillä on spesifiset ja antiaggreganttiset vaikutukset.
Asetyylisalisyylihappo imeytyy hyvin nopeasti suun kautta otettuna. Sen hydrolyysin tuote, salisyylihappo, estää verihiutaleiden syklo-oksigenaasia, mikä häiritsee arakidonihapon muuttumista prostaglandiini O2:ksi ja lopulta tromboksaani A2:ksi. Asetyylisalisyylihappo estää kollageenin, ADP:n, adrenaliinin ja serotoniinin aiheuttamaa aggregaatiota. Vaikka sen GG0 5 on 15 minuuttia, sen antiaggreganttivaikutus kestää useita päiviä, mikä ilmeisesti selittyy prostaglandiinisynteesireaktioiden peruuttamattomalla estolla ja verihiutaleiden aggregaatiotoiminnan heikkenemisellä koko niiden elinkaaren ajan (6-10 päivää). Verihiutaleiden syklo-oksigenaasin eston ohella asetyylisalisyylihappo suurina annoksina estää verisuonen seinämän syklo-oksigenaasia ja samanaikaisesti tromboksaani A2:n synteesin eston kanssa estää prostasykliinisynteesiä endoteelisoluissa. Siksi asetyylisalisyylihappoa tulisi määrätä antiaggreganttina pieninä annoksina (3000-5000 mg/vrk), jotka pääasiassa estävät verihiutaleiden aggregaatiota.
Koska asetyylisalisyylihappo estää verihiutaleiden syklo-oksigenaasin toimintaa useita päiviä ja endoteelin syklo-oksigenaasin toimintaa enintään päivän ajan, on järkevää määrätä lääkettä ei päivittäin, vaan 3-4 päivän välein. Optimaalisen asetyylisalisyylihappoannoksen valinta potilaalle tulee tehdä yksilöllisesti, koska potilaiden herkkyys lääkkeen verihiutaleiden aggregaatiota estävälle vaikutukselle on erilainen. Reaktiivisilla potilailla 0,5 g:n asetyylisalisyylihappoannos estää verihiutaleiden aggregaatiota 40-50 %, hyperreaktiivisilla potilailla kokonaan tai 80-90 %, ja allergisilla potilailla verihiutaleiden aggregaatiota estävän vaikutuksen puuttuminen on tyypillistä samalla lääkeannoksella.
Selektiiviset tromboksaanisyntetaasin estäjät ovat imidatsoli ja sen analogit, jotka eivät estä syklo-oksigenaasia. Dipyridamoli, jota käytetään kliinisessä käytännössä kroonisen iskeemisen sydänsairauden hoidossa sepelvaltimoiden laajentajana, estää imidatsolin tavoin selektiivisesti tromboksaanisyntetaasia estäen tromboksaani A2:n synteesin. Lääkkeen ja sen analogien uskotaan myös estävän verihiutaleiden fosfodiesteraasia, mikä lisää cAMP:n pitoisuutta verihiutaleissa. Tämän lisäksi dipyridamoli estää adenosiinideaminaasin aktiivisuutta ja adenosiinin ottoa verihiutaleisiin, estää serotoniinin imeytymistä verihiutaleisiin ja niiden aggregaatiota, jonka adrenaliini ja kollageeni indusoivat. On raportoitu lääkkeen heikosta verihiutaleiden vastaisesta vaikutuksesta ja sen kyvystä pieninä annoksina lisätä verihiutaleiden aggregaatiota. Luotettavin verihiutaleiden vastainen vaikutus voidaan saavuttaa dipyridamolin ja asetyylisalisyylihapon yhdistelmällä.
Hepariini
Antitromboottisista aineista yksi tehokkaimmista veren aggregaattitilan säätelijöistä on hepariini, erityisesti varhaisessa vaiheessa käytettynä. Hepariinilla on suuri negatiivinen varaus ja se kykenee vuorovaikuttamaan sekä suurten että pienten ionien ja molekyylien (entsyymit, hormonit, biogeeniset amiinit, plasmaproteiinit jne.) kanssa, joten sen biologisen vaikutuksen kirjo on melko laaja. Lääkkeellä on antitrombiini-, antitromboplastiini- ja antiprotrombiinivaikutuksia, se estää fibrinogeenin muuttumisen fibriiniksi, estää hyytymän vetäytymistä ja lisää fibrinolyysiä.
Hepariinin antikoagulanttivaikutuksen mekanismi on melko monimutkainen. On nyt todettu, että hepariinin antikoagulanttivaikutukset liittyvät antitrombiini III:n vaikutuksen voimistumiseen ja hepariini-antitrombiini III -kompleksin kyvyn tehostumiseen inaktivoida nopeasti suurin osa veren hyytymisjärjestelmän seriiniproteaaseista. Hepariinin antitromboottisessa vaikutuksessa on erittäin tärkeää sen kyky lisätä ja ylläpitää verisuonten intiman korkeaa elektronegatiivista potentiaalia, estäen verihiutaleiden adheesiota ja verihiutaleiden mikrotrombien muodostumista. Hepariini estää aktiivisimmin trombien muodostumista laskimoissa estäen sekä paikallisten trombien muodostumisen että disseminoitunutta intravaskulaarista koagulaatiota.
Prostasykliini ja sen stabiilit analogit
Verihiutaleiden aggregaatiota estävien aineiden joukossa tehokkaimpia aggregaation estäjiä ovat prostasykliini ja sen stabiilit analogit. Prostasykliinin verihiutaleiden aggregaatiota estävä vaikutus johtuu adenylaattisyklaasin stimulaatiosta ja sen seurauksena cAMP-pitoisuuden noususta verihiutaleissa, tromboksaanipitoisuuden laskusta, tromboksaani A2 -pitoisuuden laskusta ja sen reseptorien salpauksesta. Prostasykliini on epästabiili ja hydrolysoituu nopeasti inaktiivisiksi tuotteiksi, joten sitä annetaan tiputuksena laskimoon nopeudella 2–20 ng/kg minuutissa 30–60 minuutin ajan, enintään 6 kertaa päivässä.
Prostasykliinillä on voimakkaan antiaggregaattisen vaikutuksen ohella voimakas vasodilataattori ja keuhkoputkia laajentava vaikutus. Lääke laajentaa aivojen, sydämen, munuaisten, luustolihasten ja suoliliepeen verisuonia. Prostasykliinin vaikutuksesta sepelvaltimoiden verenkierto lisääntyy, sydänlihaksen energiansaanti kasvaa ja sen hapentarve vähenee. Huolimatta sen epävakaisuudesta kehossa, kliinisesti suotuisat vaikutukset voivat kestää useita viikkoja ja jopa kuukausia. Tällaisen pitkittyneen vaikutuksen mekanismi ei ole vielä selvä.
Prostasykliini on vähätoksinen lääke, mutta sen käyttö voi aiheuttaa sivuvaikutuksia: kasvojen punoitusta, päänsärkyä, verenpaineen laskua, vatsakipua, ruokahaluttomuutta. Prostasykliinin ohella sen synteettiset stabiilit analogit (iloprosti jne.) ovat lupaavia verihiutaleiden aggregaation estäjiä.
Veren viskositeettia parantavat lääkkeet
Veren reologisten ominaisuuksien häiriöt trauman ja shokin aikana johtuvat paitsi verihiutaleiden toiminnallisen aktiivisuuden muutoksista myös veren viskositeetin noususta. Veren rakenteellinen viskositeetti monimutkaisena dynaamisena hajautettuna järjestelmänä määräytyy suurelta osin plasman viskositeetin ja punasolujen kyvyn muuttaa muotoaan perusteella. Plasman viskositeetti riippuu pääasiassa veren proteiinipitoisuudesta. Pienimolekyylipainoisilla proteiineilla, kuten albumiinilla, on vain vähän vaikutusta plasman viskositeettiin, kun taas suurimolekyyliset proteiinit (fibrinogeeni, alfa- ja gammaglobuliinit, muut makromolekyylit) lisäävät sitä merkittävästi.
Alhaisilla leikkausnopeuksilla fibrinogeenin ja globuliinien adsorptio punasolujen pinnalle johtaa siltojen muodostumiseen vierekkäisten solujen välille ja punasolujen aggregaattien muodostumiseen. Aggregaattien muodostumisnopeus on monimutkainen biofysikaalinen prosessi, ja se riippuu paitsi leikkauksen suuruudesta myös punasolujen sähkökineettisistä ominaisuuksista, aggregaattorimakromolekyylien pitoisuudesta, massasta ja sorptiokyvystä sekä punasolujen muodosta ja plastisuudesta.
Erytrosyyttikalvon muodon ja mekaanisten ominaisuuksien ylläpitäminen vaatii merkittäviä energiankulutuksia. Uskotaan, että punasoluissa glykolyysin aikana tuotettu energia kuluu spektriinin fosforylaatioon, mikä johtaa muutoksiin proteiinin sekundaarirakenteessa ja vuorovaikutukseen sisäkalvon viereisten komponenttien kanssa. Kalvon rakenneproteiinien, spektriinin ja aktiinin, välinen vuorovaikutus on tärkeässä roolissa punasolukalvon mekaanisten ominaisuuksien muodostumisessa sekä punasolun pinta-alan ja paksuuden vakiona pitämisessä minkä tahansa muodonmuutoksen aikana.
Systeemisten hemodynaamisten ja elinten verenkierron häiriöiden yhteydessä punasolukalvojen jäykkyyden lisääntyminen ja punasoluaggregaattien muodostuminen johtavat punasolujen kulkunopeuden hidastumiseen kapillaarien läpi, mikä häiritsee veren kaasunkuljetustoimintoa. Siksi veren reologisten ominaisuuksien häiriöiden korjaamiseen sokissa tulisi kuulua punasolujen aggregaation estämisen ohella plasman ja veren viskositeetin normalisointi, punasolujen aggregaatio ja muodonmuutos.
Pienimolekyylisten dekstraanien lisäksi albumiiniliuokset ovat yksi tehokkaimmista keinoista lisätä veren suspension stabiilisuutta. Sokin loppuvaiheessa punasolujen yleistynyt aggregaatio tapahtuu veriplasman albumiinipitoisuuden laskun ja fibrinogeenin ja globuliinien, erityisesti alfa2-fraktion, lipoproteiinien ja lipidien, pitoisuuden nousun taustalla. Näissä olosuhteissa albumiinin reologiset vaikutukset johtuvat kahdesta päätekijästä: hemodiluutiosta ja mikro- ja makroglobulaaristen proteiinien välisen suhteen normalisoitumisesta plasmassa. Samalla albumiini sitoutuu vapaita happoja, joiden labilisoituminen trauman ja sokin aikana stimuloi veren solurakenteiden aggregaatiota ja intravaskulaarista koagulaatiota ja voi aiheuttaa rasvaemboliaa.
Verenkiertävän veren määrän täydentämiseen, kudoshypoksian ja metabolisen asidoosin poistamiseen tähtäävät anti-shokkitoimenpiteet edistävät punasolukalvojen elastisuuden normalisoitumista, koska hypoksia ja asidoosi vähentävät merkittävästi punasolujen muodonmuutoskykyä. Punasolukalvojen lisääntynyt jäykkyys sokissa liittyy todennäköisesti ATP-synteesin estymiseen punasoluissa. ATP-pitoisuuden lasku puolestaan edistää Ca2+-pitoisuuden nousua punasoluissa, mikä sitoutumalla kalvoproteiineihin lisää kalvon jäykkyyttä.
Yksi farmakologisista lääkkeistä, jotka lisäävät ATP-pitoisuutta punasoluissa ja punasolukalvojen elastisuutta, on Trental (pentoksifylliini), jota käytetään kliinisessä käytännössä iskeemisten häiriöiden hoitoon.
Erytrosyyttikalvojen jäykkyyden vähentämisen ohella Trental aiheuttaa vasodilataatiota, parantaa kudosten hapettumista, estää fosfodiesteraasiaktiivisuutta kudoksissa, lisää cAMP-pitoisuutta ja estää verihiutaleiden aggregaatiota.
Muiden punasolukalvon elastisuutta ylläpitävien farmakologisten aineiden joukossa on syytä huomata Ca2+-antagonistit, jotka rajoittavat ionien virtausta punasoluihin (flunarisiini, nifedipiini jne.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Huomio!
Tietojen käsityksen yksinkertaistamiseksi tämä huumeiden käyttöohje "Tromboosia ehkäisevät ja veren reologiaa parantavat lääkkeet" käännetään ja esitetään erityisessä muodossa huumeiden lääketieteellisen käytön virallisten ohjeiden perusteella. Ennen käyttöä lue merkintä, joka tuli suoraan lääkkeeseen.
Kuvaus on tarkoitettu informaatioteknisiin tarkoituksiin, eikä se ole opas itsehoitolle. Tämän lääkkeen tarve, hoito-ohjelman tarkoitus, lääkkeen menetelmät ja annos määräytyy yksinomaan hoitavan lääkärin mukaan. Itsehoito on vaarallista terveydelle.

