Lääketieteen asiantuntija
Uudet julkaisut
Eturauhassyövän vaiheiden diagnosointi
Viimeksi tarkistettu: 04.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Kliinisesti erotetaan toisistaan paikallinen (T1-2 , N0 , M0 ), paikallisesti levinnyt (T3-4 , N0-1 , M0 ) ja yleistynyt syöpä (T1-4 , N0-1 , M1 ).
Kliinisesti lokalisoituneen ja paikallisesti edenneen taudin potilaat luokitellaan riskiasteen mukaan (D'Amico A V. et al., 2003):
- matala: vaihe T1a -c; PSA-taso alle 10 ig/ml: Gleason-luokitus - 2-5; biopsiassa - yksipuolinen leesio alle 50 %:
- keskivaikea: vaihe T2a ; PSA-taso alle 10 ng/ml; Gleason-pisteet - 3 + 4 = 7; biopsiassa - molemminpuolinen leesio alle 50 %;
- korkea vaihe T2b , T3a -b; PSA-taso - 10-20 ng/ml; Gleason-luokitus - yli 4 + 3 - 7; biopsiassa - vaurio yli 50 %, hermoja ympäröivä invaasio;
- erittäin korkea: vaihe T4 ; PSA-taso yli 20 ng/ml; Gleason-pisteet yli 8; biopsia osoittaa lymfovaskulaarista invaasiota.
Kun diagnoosi on selvitetty ja prosessin laajuus (paikallinen, paikallisesti levinnyt tai yleistynyt) on vahvistettu, lääkärin ja potilaan on valittava hoitomenetelmä. Nyky-yhteiskunnassa potilaiden elämänlaadulle hoidon aloittamisen jälkeen annetaan suuri merkitys. Elämänlaatu ilman hoitoa vastaa perussairauden kulkua ja riippuu onkologisen prosessin etenemisestä. Elämänlaadun muutokset tapahtuvat pääasiassa hoidon aloittamisen ja jonkin terapeuttisen tai kirurgisen menetelmän käytön jälkeen. Prosessin vaiheen selkeä määrittäminen mahdollistaa paitsi optimaalisen hoitomenetelmän valinnan myös taudin jatkokulun ennustamisen.
PSA-tason määrittäminen yhdessä eturauhassyövän kliinisen kuvan ja kasvaimen Gleason-asteikon mukaisen porrastuksen kanssa lisää merkittävästi kunkin luetellun indikaattorin informaatiosisältöä syövän patologisen vaiheen määrittämisessä. AV Partin ym. (1997) ehdottivat prognostisia taulukoita, joiden avulla voidaan ennustaa kasvaimen leviämistä, hoitomenetelmän valintaa, radikaalisuuden astetta ja hoidon tehokkuuden ennustetta.
Kasvaimen leviämisen arvioimiseksi yleisimmin käytettyjä menetelmiä ovat DRE, TRUS, PSA-tason määritys ja luustokuvaus. Tarvittaessa määrätään tietokonetomografia (TT) tai magneettikuvaus (MRI) ja rintakehän röntgenkuvaus.
Mikä tahansa kuvantamismenetelmä on suunniteltu määrittämään vaihe ja arvioimaan hoidon tehokkuutta. Diagnoosin varmentamisen jälkeen urologin on selvitettävä primaarikasvaimen koko, sen rajat sekä kasvaimen invasiivinen tai metastaattinen potentiaali. Kaikilla näillä indikaattoreilla on suuri merkitys taudin ennusteelle ja hoitomenetelmän valinnalle.
Primaarinen kasvain (T)
Ensinnäkin on määritettävä, rajoittuuko kasvain eturauhaseen (T 1-2 ) vai ulottuuko se kapselin ulkopuolelle (T 3-4 ). Digitaalinen tutkimus ei usein mahdollista kasvaimen leviämisen arviointia. Joidenkin tietojen mukaan DRE:n tulokset vastaavat histologisen tutkimuksen tuloksia alle 50 %:lla potilaista. Yksityiskohtaisempi tutkimus on kuitenkin aiheellista vain radikaalista hoitoa päätettäessä.
PSA-taso voi heijastaa kasvaimen laajuutta, mutta se ei mahdollista tarkkaa morfologisen vaiheen määrittämistä. PSA-tason, Gleason-indeksin ja palpaatiotietojen yhdistelmä mahdollistaa morfologisen vaiheen paremman ennustamisen kuin kukin näistä parametreista erikseen. Vapaan PSA:n arvo on kiistanalainen: yhdessä tutkimuksessa vapaan PSA:n pitoisuuden määrittäminen auttoi selventämään paikallisten kasvainten vaihetta, mutta muut tutkimukset eivät vahvistaneet tätä. Vain perusteelliset tutkimukset auttavat ratkaisemaan tämän ongelman.
Transrektaalista ultraääntä käytetään useimmiten eturauhasen tilan tutkimiseen. Tällä menetelmällä voidaan havaita vain 60 % kasvaimista, eikä se aina osoita kapselin invaasiota. Lähes 60 %:lla T3-vaiheen potilaista ultraääni osoittaa harvinaisempaa prosessia . Kapselin invaasion ultraäänitutkimuksissa havaittuja merkkejä ovat rauhasen ääriviivan pullistuma, epätasaisuus ja repeämä. Kasvainsolujen tunkeutuminen siemenrakkuloihin on huono ennustearvo, mutta tieto siitä on erittäin tärkeää hoitomenetelmän valinnassa. TRUS-tutkimusta suoritettaessa on kiinnitettävä huomiota vesikkelien kaikurakenteeseen (hyperekogeenisyys), niiden epäsymmetriaan, muodonmuutokseen ja laajenemiseen. Myös siemenrakkulan vaurioituminen ilmenee pyöreyden menetyksenä ja tiivistymisenä rauhasen pohjassa. Nämä merkit ovat melko subjektiivisia, joten ei ole tarkoituksenmukaista luottaa kokonaan ultraäänitutkoihin. Siemenrakkulan invaasio viittaa suureen paikallisen uusiutumisen ja etäpesäkkeiden riskiin, ja niiden biopsia on aiheellista selventää tilannetta (ennen leikkausta). Tutkimusta ei pitäisi aloittaa tällä toimenpiteellä, mutta jos invaasion riski on suuri ja hoidon valinta riippuu biopsian tuloksesta, sen käyttöönotto on perusteltua. Negatiivinen tulos ei sulje pois mikroskooppista invaasiota. Siemenrakkulan biopsia tehdään yleensä kliinisessä vaiheessa T2b tai sitä korkeammassa ja PSA-pitoisuudessa yli 10 ng/ml. Tulosta pidetään positiivisena, jos ainakin yksi eturauhasen pohjasta otettu biopsia sisältää kasvainsoluja. Lisätutkimusten lisäksi myös primaaribiopsian tulosten perusteellinen analyysi mahdollistavat vaiheen kliinisen määrityksen tarkkuuden lisäämisen (kasvainpesäkkeiden lukumäärällä ja laajuudella sekä kapselin invaasiolla on merkitystä). Myös erilaistumisaste on tärkeä: alle 6:n Gleason-indeksin ollessa kasvain lokalisoituu 70 %:ssa tapauksista.
Veren virtaus eturauhasessa syövän yhteydessä on suurempi kuin normaalissa eturauhasessa tai sen hyperplasiassa. Kastraation jälkeen veren virtauksen intensiteetti eturauhasessa vähenee. Eturauhassyövän diagnosointiin ja seurantaan tarkoitettujen kaiku-dopplerografisten karttojen kehittäminen on lupaavaa, mutta tällä hetkellä ei ole luotettavaa tietoa kaiku-dopplerografian käytöstä paikallisen prosessin vaiheen määrittämisessä. Tällä menetelmällä on mahdollista saada lisämateriaalia kohdennetun biopsian aikana patologisen verisuonituksen pesäkkeistä.
Eturauhassyövän visualisoinnin tulokset riippuvat suoraan klinikan teknisistä laitteista ja asiantuntijan kokemuksesta. Siksi kaikilla nykyaikaisilla visualisointimenetelmillä ei ole ratkaisevaa vaan selventävää roolia, ja hoitomenetelmän valinta perustuu kliinisen tutkimuksen tietojen ja instrumentaalisten tutkimusten yhdistelmään.
Magneettikuvauksella (MRI) on parhaat ominaisuudet eturauhasen rakenteen visualisointiin. Nykyaikainen standardi lantion elinten tutkimiseen MRI-menetelmällä on endorektaalisen anturin käyttö, jonka avulla saadaan kuva, jolla on mahdollisimman suuri spatiaalinen resoluutio, 0,5–1 mm. Ilman pakottaminen endorektaaliseen anturiin tarjoaa selkeän visualisoinnin eturauhasen kapselista, suorakaiteen muotoisista kulmista ja Denonvillierin suorakaiteen muotoisesta eturauhasen faskiasta. Endorektaalisen anturin käyttö MRI:ssä ei rajoita alueellisten imusolmukkeiden (vatsa-aortan haarautumisen tasolle asti) visualisointia. Eturauhassyövälle on ominaista alhainen signaalin intensiteetti T-painotetuissa kuvissa, kun taustalla on korkea signaalin intensiteetti eturauhasen muuttumattomalta perifeeriseltä alueelta. Epäsäännöllinen muoto, diffuusi leviäminen massavaikutuksella, epäselvät ja epätasaiset ääriviivat ovat morfologisia ominaisuuksia eturauhasen perifeerisen alueen matalan signaalin omaaville pesäkkeille, jotka viittaavat leesion neoplastiseen luonteeseen. Dynaamista kontrastia suoritettaessa syöpäpesäkkeet keräävät varjoainetta nopeasti valtimofaasiin ja poistavat sen nopeasti, mikä heijastaa angiogeneesin astetta ja vastaavasti kasvaimen pahanlaatuisuuden astetta. Alhainen signaalin intensiteetti on tyypillistä myös biopsian jälkeisten verenvuotojen, prostatiitin, rauhasten neutraalivyöhykkeen stromaalisen hyvänlaatuisen hyperplasian, fibromyalgia-arpimuutosten, fibromuskulaarisen hyperplasian sekä hormoni- tai sädehoidon seurausten yhteydessä. Magneettikuvaus ilman dynaamista kontrastia ei mahdollista useimpien lueteltujen muutosten ja sairauksien luotettavaa erottelua.
Kuten edellä todettiin, yksi eturauhassyövän kuvantamismenetelmien päätehtävistä on määrittää rauhasvaurion tilavuus ja kasvaimen leviäminen kapselin ulkopuolelle. Kasvaimen tilavuuden määrittäminen on tärkeää ennusteen kannalta. Alle 4 cm3:n kasvaimen tilavuus osoittaa kaukaisia etäpesäkkeitä, ja 12 cm3 osoittaa erittäin suurta etäpesäkkeiden todennäköisyyttä. Tutkimusten mukaan magneettikuvauksen tarkkuus eturauhasen neoplastisten leesioiden havaitsemisessa vaihtelee 50–90 %:n välillä. Magneettikuvauksen herkkyys eturauhassyövän lokalisoinnin määrittämisessä on noin 70–80 %, kun taas mikroskooppisia syöpäpesäkkeitä (fokus) ei voida havaita magneettikuvauksella.
Endorektaalisen magneettikuvauksen tärkein etu on kyky paikantaa neoplastisia leesioita alueille, joihin muilla diagnostisilla menetelmillä ei päästä käsiksi, ja selventää kasvaimen kasvun luonnetta ja suuntaa. Esimerkiksi magneettikuvauksen avulla voidaan havaita neoplastisia leesioita eturauhasen perifeerisen alueen etuosissa, joihin ei päästä käsiksi transrektaalisella biopsialla. Yleisesti ottaen magneettikuvaus täydentää merkittävästi DRE:n ja TRUS:n tietoja kasvaimen lokalisoinnista.
Endorektaalinen magneettikuvaus mahdollistaa rauhaskapselin, verisuoni-hermokimpujen, siemenrakkulan, rauhaskärjen ja eturauhasta ympäröivän laskimopunoksen visualisoinnin sekä rauhaskasvaimen paikallisen esiintyvyyden määrittämisen. On korostettava, että kapselin läpäisyä pidetään mikroskooppisena merkkinä, eivätkä edes nykyaikaiset magneettikuvauslaitteet (endorektaalinen kela) pysty tarjoamaan tällaista tietoa. Tietoa on mahdollista saada vain rauhaskapselin ulkopuolisesta kasvusta.
Ekstrakapsulaarisen laajennuksen diagnostiset kriteerit MRI:llä:
- ekstrakapsulaarisen kasvaimen läsnäolo;
- rauhasen epätasainen muoto (muodonmuutos, kulmaisuus);
- neurovaskulaaristen kimppujen epäsymmetria;
- suorakulmaisten eturauhasen kulmien häviäminen;
- kasvaimen laaja kosketus kapseliin.
Magneettikuvauksen tulosten korkein spesifisyys (jopa 95–98 %) ja tarkkuus saavutetaan tutkittaessa potilaita, joilla on keskisuuri tai suuri ekstrakapsulaarisen invaasion riski. Uskotaan, että ekstrakapsulaarinen invaasio (magneettikuvaustietojen mukaan) viittaa kirurgisen hoidon sopimattomuuteen ja taudin epäsuotuisaan ennusteeseen. Hormonaali- tai sädehoito ei vaikuta eturauhassyövän ekstrakapsulaarisen leviämisen havaitsemisen tarkkuuteen. Suurin vaikeus syöpäpesäkkeiden ja kasvaimen ekstrakapsulaarisen leviämisen havaitsemisessa on eri asiantuntijoiden tomogrammien tulkinnan suuri vaihtelu. Sädediagnostiikan asiantuntijan ensisijainen tehtävä on saavuttaa korkea diagnostinen spesifisyys (jopa herkkyyden kustannuksella), jotta leikkauskelpoisilta potilailta ei estetä radikaalin hoidon mahdollisuutta.
Syöpä-, hyperplastisen ja normaalin eturauhaskudoksen tiheyden samankaltaisuus TT-kuvauksessa tekee tästä menetelmästä vain vähän hyödyllisen kasvaimen paikallisen leviämisen arvioinnissa. Siemenrakkulan tunkeutuminen on tärkeämpää kuin kapseleiden tunkeutuminen, mutta tässäkin tapauksessa TT antaa tietoa vain pitkälle edenneissä tapauksissa. Tätä menetelmää käytetään kuitenkin aktiivisesti iskualueen merkitsemiseen ennen sädehoitoa.
Sädehoidon hidas kehitys maassamme on johtanut eturauhassyövän myöhäiseen diagnosointiin ja siten radikaalien eturauhassyövän hoitomenetelmien (esimerkiksi prostatektomia) riittämättömään yleisyyteen, nykyaikaisten tomografien heikkoon saatavuuteen sekä sädehoidon asiantuntijoiden ja urologien asianmukaisten koulutusohjelmien puutteeseen. Huolimatta siitä, että tietokonetomografia ja magneettikuvaus ovat nykyään laajalle levinneitä, vastaanottojen varustelutaso ja sädehoidon asiantuntijoiden koulutus eivät ole riittäviä, jotta saadut tiedot olisivat ratkaisevia eturauhassyöpäpotilaiden hoitomenetelmän valinnassa.
Alueelliset imusolmukkeet (N)
Alueelliset imusolmukkeet tulisi arvioida vain silloin, kun se vaikuttaa suoraan hoitostrategiaan (yleensä radikaalia hoitoa suunniteltaessa). Korkeat PSA-arvot, T2c -T3a- kasvaimet, heikko erilaistuminen ja hermoja ympäröivä invaasio liittyvät suureen imusolmukkeiden etäpesäkkeiden riskiin. Imusolmukkeiden tilan arviointia PSA-arvojen perusteella pidetään riittämättömänä.
Vain imusolmukkeiden poisto (avoin tai laparoskooppinen) antaa tarvittavat tiedot. Viimeaikaiset laajennetun imusolmukkeiden poiston tutkimukset ovat osoittaneet, että eturauhassyöpä ei aina vaikuta sulkuimusolmukkeisiin. Oireettomissa kasvaimissa ja alle 20 kg/ml PSA-tasoissa TT vahvistaa suurentuneet imusolmukkeet vain 1 %:ssa tapauksista. Magneettikuvauksen tai tietokonetomografian käyttö on perusteltua tapauksissa, joissa etäpesäkkeiden riski on suuri, koska näiden menetelmien spesifisyys on 93–96 %. Jopa positiivinen tulos niitä käytettäessä voi kuitenkin olla väärä, ja vasta epäilyttävän imusolmukkeen punktio antaa mahdollisuuden kieltäytyä imusolmukkeiden poistosta. Retrospektiivisen analyysin mukaan imusolmukkeen koko ei aina osoita etäpesäkkeiden esiintymistä siinä; sairastuneiden imusolmukkeiden epäsymmetriaa pidetään informatiivisempana merkkinä. Tällä hetkellä vain 2–3 %:lla potilaista, joille on tehty radikaali prostatektomia paikallisen eturauhassyövän vuoksi, diagnosoidaan etäpesäkkeitä imusolmukkeisiin leikkauksen jälkeisen histologisen tutkimuksen perusteella.
Positroniemissiotomografiaa (PET) ja leimattujen vasta-aineiden kanssa tehtävää skintigrafiaa suositellaan imusolmukkeiden etäpesäkkeiden havaitsemismenetelmiksi, mutta niiden käyttö on edelleen rajallista riittämättömän herkkyyden vuoksi.
Partinin nomogrammeja (2001) voidaan käyttää alueellisten imusolmukkeiden leviämisriskin arviointiin. Nomogrammit ovat matemaattisia algoritmeja, joita käytetään tietylle potilaalle tai potilasryhmälle. Näiden taulukoiden avulla voidaan määrittää paikallisen kasvaimen leviämisen todennäköisyys (kapseliin, siemenrakkulaan) ja imusolmukkeiden leviämisen todennäköisyys kliinisen vaiheen, PSA-tason ja Gleason-indeksin perusteella. Erityisesti ne mahdollistavat sellaisten potilasryhmien tunnistamisen, joilla on pieni (alle 10 %) imusolmukkeiden etäpesäkkeiden todennäköisyys (PSA-taso yli 20 ng/md, vaihe T1-2a ja Gleason-indeksi 2-6); tässä ryhmässä imusolmukkeiden tilaa ei voida määrittää ennen radikaalia hoitoa. Imusolmukkeiden etäpesäkkeiden riskiä voidaan arvioida myös havaitsemalla kasvainalueita, joilla on voimakas anaplasia (4-5 pistettä): jos tällaisia alueita löytyy neljästä tai useammasta biopsiasta tai ne ovat vallitsevia ainakin yhdessä biopsiassa, riski on 20-45 %. Muilla potilailla se ei ylitä 2,5 %. Tällaisissa tapauksissa lisätutkimuksia ei tarvita.
Kaukaiset etäpesäkkeet (M)
85 prosentilla eturauhassyöpään kuolleista potilaista havaitaan aksiaalisen luuston vaurioita. Luumetastaaseja syntyy, kun syöpäsolut tunkeutuvat veren mukana luuytimeen, mikä johtaa kasvaimen kasvuun ja luurakenteiden hajoamiseen. Luumetastaasien esiintyvyys vaikuttaa ennusteeseen, ja niiden varhainen havaitseminen varoittaa lääkäriä mahdollisista komplikaatioista. 70 prosentissa tapauksista metastaaseihin liittyy luuisoentsyymin alkalisen fosfataasin (ALP) aktiivisuuden lisääntyminen. ALP:n aktiivisuuden ja PSA-tason määrittäminen mahdollistaa useimmissa tapauksissa luumetastaasien havaitsemisen. Monimuuttuja-analyysin mukaan näihin indikaattoreihin vaikuttaa vain luumetastaasien lukumäärä. On tärkeää, että luuisoentsyymin ALP:n aktiivisuus heijastaa luuvaurion astetta tarkemmin kuin PSA-taso.
Skintigrafiaa pidetään herkimpänä menetelmänä luumetastaasien havaitsemiseksi (se on parempi kuin radiografia ja alkalisen ja happaman fosfataasin aktiivisuuden määritys). Teknetiumdifosfonaatteja käytetään paremmin radiofarmaseuttisena lääkkeenä, koska niiden kertyminen luihin on paljon aktiivisempaa kuin pehmytkudoksiin. Luuvaurioiden semikvantitatiivisen arvioinnin ja eloonjäämisen välillä on osoitettu korrelaatio. Etämetastaasien havaitseminen on mahdollista missä tahansa elimessä. Niitä esiintyy useimmiten ei-alueellisissa imusolmukkeissa, keuhkoissa, maksassa, aivoissa ja ihossa. Vastaavien oireiden ja vaivojen ilmetessä niiden havaitsemiseksi käytetään rintakehän röntgenkuvausta, ultraääntä, TT- ja MRI-kuvausta. Epäiltyjen luumetastaasien taktiikat on esitetty kaaviossa.
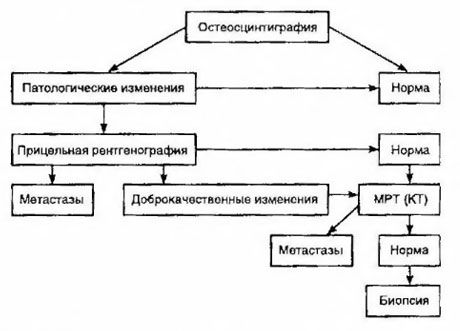
Luotettavin laboratorioindikaattori, joka auttaa määrittämään etäpesäkkeiden asteen, on PSA-taso. On osoitettu, että sen nousu yli 100 ng/ml on ainoa parametri, joka luotettavasti osoittaa kaukaiset etäpesäkkeet. PSA-tason määrittäminen vähentää luustokuvausta tarvitsevien potilaiden määrää. Luustometastaasien havaitsemisen todennäköisyys PSA-tason laskiessa on hyvin pieni. Jos vaivoja ei ole ja alkuperäinen PSA-pitoisuus on alle 20 ng/ml, voidaan välttää vahvasti ja kohtalaisesti erilaistuneiden kasvainten havaitseminen. Samalla huonosti erilaistuneiden kasvainten ja kapselin invaasion tapauksessa gammakuvaus on aiheellista (PSA-tasosta riippumatta).


 [
[