Lääketieteen asiantuntija
Uudet julkaisut
Tavanomainen keskenmeno - Syyt
Viimeksi tarkistettu: 04.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
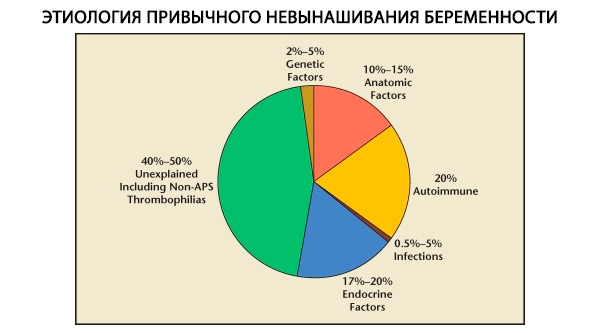
Tavanomaisten keskenmenojen rakenteessa erotetaan toisistaan geneettiset, anatomiset, hormonaaliset, immunologiset ja infektiotekijät. Kun kaikki edellä mainitut syyt suljetaan pois, jäljelle jää ryhmä potilaita, joilla tavanomaisen keskenmenon alkuperä on epäselvä (idiopaattiset keskenmenot). C. Coulamin ym. (1996) mukaan 80 % idiopaattisista keskenmenoista perustuu tunnistamattomiin immuunijärjestelmän häiriöihin.
Ei ole vakuuttavaa näyttöä siitä, että endometrioosi aiheuttaisi toistuvia keskenmenoja tai että endometrioosin lääketieteellinen tai kirurginen hoito vähentäisi toistuvien keskenmenojen esiintyvyyttä.
Nykykäsitysten mukaan geneettisten ja osittain tarttuvien syiden lisäksi, jotka johtavat epänormaalin alkion muodostumiseen, muiden tekijöiden (anatomisten, hormonaalisten, immunologisten) vahingollisen vaikutuksen toteutuminen koostuu epäsuotuisan taustan luomisesta geneettisesti täydellisen hedelmöitetyn munasolun kehitykselle, mikä johtaa suonikalvon varakapasiteetin ehtymiseen ja kehityksen pysähtymiseen (alkionkehitys). Kriittisiksi jaksoiksi raskauden ensimmäisen kolmanneksen aikana katsotaan 6-8 viikkoa (alkion kuolema) ja 10-12 viikkoa (hedelmöittyneen munasolun poistuminen).
 [ 1 ]
[ 1 ]
Tavallisen keskenmenon geneettiset syyt
Geneettiset tekijät selittävät 3–6 %:a tavanomaisen keskenmenon syistä. Satunnaisessa raskaudenkeskeytymisessä ensimmäisen kolmanneksen aikana noin 50 %:lla aborteista on kromosomipoikkeavuuksia. Suurin osa niistä (95 %) on kromosomimäärän muutoksia – monosomia (yhden kromosomin menetys), trisomia (lisäkromosomin läsnäolo), jotka johtuvat meioosin virheistä, sekä polyploidia (kromosomikoostumuksen lisääntyminen täyden haploidisen joukon myötä), joka tapahtuu, kun munasolu hedelmöittyy kahdella tai useammalla siittiösolulla. Satunnaisissa keskenmenoissa trisomia on yleisin – 60 % kaikista mutaatioista (useimmiten kromosomissa 16, sekä 13, 18, 21, 22), toiseksi yleisin on Shereshevsky-Turnerin oireyhtymä (kromosomi 45 X0) – 20 %, loput 15 % johtuu polyploidiasta (erityisesti triploidiasta).
Jos abortissa havaitaan kromosomimäärän muutos, vanhempien karyotyypin tutkiminen ei useimmiten paljasta mitään patologiaa, ja sikiön kromosomisairauden todennäköisyys myöhemmässä raskaudessa on 1 %. Sitä vastoin tutkittaessa abortteja pariskunnilla, joilla on tapana keskenmeno, kromosomien rakenteellisia muutoksia (kromosomien sisäisiä ja välisiä) havaitaan 3–6 %:ssa tapauksista. Vanhempien karyotyyppiä tutkittaessa tasapainoisia kromosomien uudelleenjärjestelyjä havaitaan 7 %:ssa tapauksista. Useimmiten nämä ovat resiprookkisia translokaatioita, joissa yhden kromosomin segmentti sijaitsee toisen ei-homologisen kromosomin segmentin paikalla, sekä sukupuolikromosomien mosaiikkisuutta, inversiota ja kromosomien havaitsemista renkaan muodossa. Tällaisten uudelleenjärjestelyjen esiintyessä toisella puolisolla kromosomien pariutumis- ja erottumisprosessit estyvät meioosin aikana, mikä johtaa kromosomiosien menetykseen (deleetioon) tai kahdentumiseen (duplikaatioon) sukusoluissa. Tämä johtaa niin sanottuihin epätasapainoisiin kromosomimuutoksiin, joissa alkio on joko elinkelvoton tai kantaa vakavaa kromosomipoikkeavuutta. Todennäköisyys sille, että lapsella on epätasapainoisia kromosomipoikkeavuuksia, jos toisen vanhemman karyotyypissä on tasapainoisia kromosomimuutoksia, on 1–15 %. Tiedon erot liittyvät uudelleenjärjestelyjen luonteeseen, kyseessä olevien segmenttien kokoon, kantajan sukupuoleen ja sukuhistoriaan.
Diagnostiikka
Anamneesi
- Perinnölliset sairaudet perheenjäsenillä.
- Synnynnäisten poikkeavuuksien esiintyminen perheessä.
- Kehitysvammaisten lasten syntymä.
- Tuntemattomasta syystä johtuvan hedelmättömyyden ja/tai keskenmenon esiintyminen avioparilla tai sukulaisilla.
- Epäselvien perinataalikuolleisuuden tapausten esiintyminen.
Erityiset tutkimusmenetelmät
- Vanhempien karyotyypin tutkimus on erityisen aiheellista aviopareille vastasyntyneen syntymän yhteydessä, jolla on kehityshäiriöitä keskenmenojen lisäksi, sekä raskauden alkuvaiheessa tapahtuneiden tavanomaisten keskenmenojen tapauksissa.
- Abortin sytogeneettinen analyysi kohtukuoleman tai vastasyntyneen kuolleisuuden tapauksissa.
Indikaatiot muiden asiantuntijoiden konsultoinnille
Jos vanhemmilla havaitaan muutoksia karyotyypissä, on tarpeen käydä geneetikon konsultaatiossa, jotta voidaan arvioida patologian saamisen riskiä tai tarvittaessa päättää munasolun tai siittiöiden luovuttamisesta.
Potilaan jatkohoito
Jos avioparilla on patologinen karyotyyppi, jopa toisella vanhemmista, on suositeltavaa suorittaa synnytystä edeltävä diagnostiikka raskauden aikana - istukkabiopsia tai lapsivesipunktio - sikiön kehityshäiriöiden suuren riskin vuoksi.
Tavallisen keskenmenon anatomiset syyt
Tavallisen keskenmenon anatomisia syitä ovat:
- synnynnäiset kohdun kehityksen poikkeavuudet (kohdun täydellinen kaksinkertaistuminen; kaksisarveis-, satulanmuotoinen, yksisarvisen kohtu; osittainen tai täydellinen kohdunsisäinen väliseinä);
- hankitut anatomiset viat;
- kohdunsisäiset kiinnikkeet (Ashermanin oireyhtymä);
- submukoosiset kohdun myoomit;
- ismaattinen-kohdunkaulan vajaatoiminta.
Anatomisten poikkeavuuksien esiintyvyys potilailla, joilla on toistuva keskenmeno, vaihtelee 10–16 %:n välillä. Kohdun epämuodostumien, jotka voivat johtaa keskenmenoon (mutta eivät hedelmättömyyteen), esiintyvyys suhteessa kaikkiin kohdun epämuodostumiin on seuraava: kaksisarvinen kohtu - 37 %, satulanmuotoinen kohtu - 15 %, kohdun väliseinä - 22 %, kohdun täydellinen kaksinkertaistuminen - 11 %, yksisarvinen kohtu - 4,4 %.
Tavanomaisen keskenmenon diagnosointi
Anamneesi
Kohdun anatomisessa patologiassa havaitaan useammin raskauden myöhäisiä päättymisiä ja ennenaikaisia synnytyksiä, mutta implantaation yhteydessä kohdunsisäiseen väliseinään tai myomatoosisolmukkeen lähelle myös raskauden ennenaikainen päättyminen on mahdollista.
Ismaalisen-kohdunkaulan vajaatoiminnan patognomoninen merkki on raskauden spontaani keskenmeno toisen kolmanneksen aikana tai ennenaikainen ennenaikainen synnytys, joka tapahtuu suhteellisen nopeasti ja vähällä kivulla.
Kohdun epämuodostumien yhteydessä on kiinnitettävä huomiota virtsateiden patologian anamnestisiin viitteisiin (usein kohdun synnynnäisten poikkeavuuksien yhteydessä) ja kuukautistoiminnan kehityksen luonteeseen (viitteet hematometrasta, jossa on toimiva alkeellinen kohdun sarvi).
Erityiset tutkimusmenetelmät
- Tällä hetkellä hysterosalpingografiaa käytetään diagnoosin tekemiseen, ja sen avulla voidaan tutkia kohdun ontelon muotoa, havaita submukoottisia myoomia, kiinnikkeitä ja väliseiniä sekä määrittää munanjohtimien avoimuus. Kohdun patologian diagnosoimiseksi hysterosalpingografia on järkevää suorittaa kuukautisten ja ovulaation välisenä aikana, eli kuukautiskierron ensimmäisessä vaiheessa verisen vuodon loppumisen jälkeen (kierron 7.–9. päivä). Ismaalisen-kohdunkaulan vajaatoiminnan diagnosoimiseksi tutkimus suoritetaan kuukautiskierron toisessa vaiheessa (18.–20. päivä) kohdunkaulan sisäsuonten tilan määrittämiseksi. Ennen hysterosalpingografian suorittamista on tarpeen sulkea pois lantion elinten tulehdussairaudet tai hoitaa ne.
- Hysteroskopiasta on tullut viime vuosina laajalle levinnyt menetelmä, josta on tullut kohdunsisäisen patologian diagnosoinnin kultainen standardi. Koska se on kuitenkin kalliimpi kuin hysterosalpingografia, menetelmää käytetään naisilla, joilla on alustavien ultraäänitietojen perusteella viitteitä kohdunsisäisestä patologiasta. Hysteroskopialla voidaan tutkia kohdunonteloa, määrittää kohdunsisäisen patologian luonne ja, jos tarvittavat laitteet (resektoskooppi) ovat saatavilla, suorittaa minimaalisesti invasiivinen kirurginen hoito - kiinnikkeiden, submukoottisten myoomien ja endometriumpolyyppien poisto. Kohdunsisäistä väliseinää poistettaessa etusijalla on hysteroresektoosi laparoskooppisella ohjauksella, mikä estää kohdun seinämän puhkeamisen mahdollisuuden.
- Ultraäänitutkimus tehdään kuukautiskierron ensimmäisessä vaiheessa, jolloin voidaan alustavasti diagnosoida submukoosinen kohdun myooma ja kohdunsisäiset kiinnikkeet, ja kierron toisessa vaiheessa havaita kohdun väliseinä ja kaksisarvinen kohtu. Tämä menetelmä on erityisen tärkeä raskauden alkuvaiheessa, jolloin sen herkkyys näiden tilojen diagnosoinnissa on 100 % ja spesifisyys 80 %. Raskauden ulkopuolella diagnoosi vaatii lisävahvistusta muilla menetelmillä.
- Ulkomaiset kirjoittajat korostavat sonohysterografian (ultraäänitutkimus transvaginaalisella anturilla, jossa kohtuonteloon ruiskutetaan ensin 0,9-prosenttista natriumkloridiliuosta) etua hysterosalpingografiaan verrattuna, sillä se mahdollistaa erotusdiagnostiikan kohdunsisäisen väliseinän ja kaksisarveiskohtuun välillä. Sonohysterografialla on mahdollista paitsi tutkia kohdun ontelon muotoa, myös määrittää kohdun pohjan konfiguraatio. Maassamme tämä menetelmä ei ole vielä yleistynyt.
- Joissakin monimutkaisissa tapauksissa diagnoosin varmistamiseksi käytetään lantion elinten magneettikuvausta. Menetelmän avulla saadaan arvokasta tietoa kohdun kehityshäiriöistä, joihin liittyy elinten epätyypillinen järjestys lantiossa. Magneettikuvaus on tärkeä, jos kohdun sarvi on alkeellinen, jotta voidaan päättää, onko sen poistaminen tarkoituksenmukaista. Alkeellinen kohdun sarvi on poistettava, jos se on yhteydessä munanjohtimeen ja munasarjaan, jotta hedelmöittyneen munasolun muodostuminen ja kehitys siinä estyisi. Raskauden keskeytymiseen kohdun anatomisten poikkeavuuksien yhteydessä voi liittyä hedelmöitetyn munasolun epäonnistunut kiinnittyminen (kohdun väliseinään, lähelle submukoosista myoomasolmuketta), riittämättömästi kehittynyt verisuonitus ja kohdun limakalvon vastaanotto, läheiset alueelliset suhteet kohdun ontelossa (esimerkiksi myoomasolmukkeen aiheuttaman ontelon muodonmuutoksen tapauksessa), usein ICI:n kanssa, ja hormonaaliset häiriöt.
Tavanomaisen keskenmenon hoito
Kirurginen hoito
Kohdunsisäisen väliseinän, submukoottisten myooma-imusolmukkeiden ja kiinnikkeiden yhteydessä tehokkain kirurginen hoito on hysteroresektoosi. Seuraavien keskenmenojen esiintymistiheys tässä naisryhmässä hoidon jälkeen on 10 % verrattuna 90 %:iin ennen leikkausta. Verratessaan laparotomialla ja transservikaalisella hysteroresektoosilla suoritetun metroplastian tuloksia P. Heinonen (1997) sai tuloksia, jotka osoittivat vähäisemmän trauman ja hysteroresektoosian suuremman tehokkuuden; elinkelpoisten lasten syntymään johtaneiden raskauksien osuus oli vastaavasti 68 ja 86 %.
Kohdunsisäisen väliseinän, kiinnikkeiden ja submukoottisten myooma-imusolmukkeiden kirurginen poisto estää keskenmenon 70–80 %:ssa tapauksista. Se on kuitenkin tehoton naisilla, joilla on kohdun epämuodostumia ja jotka ovat synnyttäneet normaalisti ja saaneet toistuvia keskenmenoja. On todennäköistä, että tällaisissa tapauksissa anatominen tekijä ei ole johtava syy, ja on tarpeen etsiä muita keskenmenon syitä.
On osoitettu, että vatsan metroplastiaan liittyy merkittävä leikkauksen jälkeisen hedelmättömyyden riski eikä se paranna myöhemmän raskauden ennustetta. Siksi on parempi suosia hysteroskopiaa ja laparoskooppisia leikkauksia.
Lääkehoito
Kierukan, suurten estrogeeniannosten, Foley-katetrin asettamisen kohtuonteloon kiinnikkeiden poistoleikkauksen tai kohdunsisäisen väliseinän poistoleikkauksen jälkeen tehokkuutta ei ole osoitettu. Raskauden suunnittelua suositellaan aikaisintaan 3 kuukauden kuluttua leikkauksesta. Endometriumin kasvun parantamiseksi suoritetaan syklinen hormonihoito 3 kuukautiskierron ajan [14]. Syklin ensimmäisten 14 päivän aikana 3 kuukauden ajan on suositeltavaa ottaa lääkettä, joka sisältää 2 mg 17-beeta-estradiolia, seuraavien 14 päivän aikana - 2 mg 17-beeta-estradiolia ja 20 mg dydrogesteronia (10 mg dydrogesteronia osana yhdistelmälääkettä + 10 mg dydrogesteronia erillisessä tablettimuodossa).
Potilaan jatkohoito
Raskauden kulun ominaisuudet kaksisarveiskohdulla tai kohdun kaksinkertaistumisella (kun kohdun onteloita on kaksi):
- raskauden alkuvaiheessa verenvuotoa esiintyy usein "tyhjästä" sarvesta tai kohdun ontelosta voimakkaan desiduaalisen reaktion vuoksi; taktiikan tulisi tässä tapauksessa olla konservatiivista ja koostua antispasmodisten ja hemostaattisten aineiden käytöstä;
- raskauden keskeyttämisen uhka eri vaiheissa;
- isthmisen ja kohdunkaulan vajaatoiminnan kehittyminen;
- istukan vajaatoiminnasta johtuva kohdunsisäinen kasvun hidastuminen.
Raskauden alkuvaiheessa verenvuodon sattuessa on suositeltavaa noudattaa vuode- ja puolivuodelepoa sekä antaa hemostaattisia, kouristuksia lievittäviä ja rauhoittavia lääkkeitä ja käyttää gestageenihoitoa (dydrogesteronia vuorokausiannoksella 20–40 mg) 16–18 raskausviikkoon asti.
Tavallisen keskenmenon endokriiniset syyt
Eri kirjoittajien mukaan keskenmenojen hormonaaliset syyt ovat 8–20 %:n osio. Merkittävimpiä näistä ovat luteaalivaiheen puutos, LH:n liikatuotanto, kilpirauhasen toimintahäiriö ja diabetes mellitus.
Vaikea kilpirauhasen sairaus tai diabetes mellitus voi johtaa toistuviin keskenmenoihin. Kompensoidussa diabeteksessa totunnaisten keskenmenojen riski ei kuitenkaan eroa väestön keskiarvosta.
Samaan aikaan kilpirauhasen vajaatoiminnan korkea esiintyvyys väestössä edellyttää seulontaa TSH-tasojen mittauksella. Potilailla, joilla on tavanomainen keskenmeno, luteaalivaiheen vajaatoiminta havaitaan 20–60 %:lla tapauksista ja monirakkulasolumunasarjojen ultraäänilöydökset 44–56 %:lla tapauksista. Kirjallisuuden mukaan yksittäisten hormonaalisten häiriöiden vaikutus tavanomaisen keskenmenon oireyhtymän muodostumiseen on edelleen kiistanalainen. M. Ogasawaran ym. (1997) tutkimukset eivät paljastaneet luotettavia eroja raskaudenkeskeytyksen esiintymistiheydessä LPI:n kanssa ja ilman sitä potilailla, joilla oli kaksi tai useampia aiempia keskenmenoja, pois lukien autoimmuunisairaudet, anatomiset ja tarttuvat syyt.
Corpus luteumin toiminnan riittämättömyys voi johtua useista epäsuotuisista tekijöistä:
- FSH:n ja LH:n erityksen häiriöt kuukautiskierron ensimmäisessä vaiheessa;
- LH:n vapautumisen varhainen tai päinvastoin liian myöhäinen huippu;
- hypoestrogenismi riittämättömän follikulogeneesin seurauksena. Kaikkia näitä tiloja ei voida korjata korvaushoidolla gestageenilääkkeillä postovulatorisessa vaiheessa. L. Reganin ym. tekemät prospektiiviset tutkimukset osoittivat merkittävää keskenmenojen esiintymistiheyden kasvua potilailla, joilla oli LH:n liikasekretio kuukautiskierron 8. päivänä, verrattuna naisiin, joilla oli normaali veren LH-pitoisuus (65 % ja 12 % keskenmenoista). LH:n ennenaikaisen lisääntymisen haitallinen vaikutus liittyy toisen meioottisen jakautumisen ennenaikaiseen jatkumiseen ja kypsymättömän munasolun ovulaatioon sekä theca-solujen androgeenituotannon indusoitumiseen yhdessä endometriumin vastaanottohäiriöiden kanssa gestageenin vajaatoiminnan vaikutuksesta. Preovulatoristen LH-pitoisuuksien alustava alentaminen gonadotropiinia vapauttavalla hormonilla (GHO) ilman lisätoimenpiteitä myöhemmän raskauden pidentämiseksi ei kuitenkaan tarjoa odotettua keskenmenojen esiintymistiheyden vähenemistä.
NLF:n diagnosoinnin kultainen standardi on histologinen tutkimus endometriumbiopsiasta, joka on otettu kierron toisessa vaiheessa kahden kuukautiskierron aikana.
Muiden ovulaatiohäiriöiden syiden, kuten hyperprolaktinemian, kilpirauhasen vajaatoiminnan tai androgeenien (munasarjojen tai lisämunuaisten) toiminnallisen ylimäärän, diagnosointiin on liitettävä asianmukaisen hoidon määrääminen.
Diagnostiikka
Historia ja fyysinen tutkimus
- Historia. Huomioitavia tekijöitä: myöhäiset kuukautiset, epäsäännöllinen kuukautiskierto (oligomenorrea, amenorrea, äkillinen painonnousu, painonpudotus, hedelmättömyys, toistuvat varhaiset keskenmenot).
- Tutkimus: ruumiinrakenne, pituus, paino, hirsutismi, toissijaisten sukupuoliominaisuuksien vaikeusaste, strioiden esiintyminen, rintarauhasten tutkiminen galaktorrean varalta.
- Toiminnalliset diagnostiset testit: peräsuolen lämpötilan mittaus kolmen kuukautiskierron aikana.
Erityiset tutkimusmenetelmät
- Hormonaalinen tutkimus:
- kuukautiskierron ensimmäisessä vaiheessa (7.–8. päivä) – FSH:n, LH:n, prolaktiinin, TSH:n, testosteronin, 17-hydroksiprogesteronin (17-OP) ja DHEAS:n pitoisuuksien määritys;
- kuukautiskierron toisessa vaiheessa (21–22 päivää) – progesteronipitoisuuden määritys (progesteronitasojen normatiiviset indikaattorit vaihtelevat suuresti, menetelmää ei voida käyttää ottamatta huomioon muita tekijöitä).
- Ultraääni:
- kuukautiskierron ensimmäisessä vaiheessa (5.–7. päivä) – endometriumin patologian, monirakkulaisten munasarjojen diagnosointi;
- kuukautiskierron toisessa vaiheessa (20–21 päivää) – kohdun limakalvon paksuuden mittaus (normaali 10–11 mm, korreloi progesteronipitoisuuden kanssa).
- Endometriumin koepala NLF:n varmistamiseksi tehdään kaksi päivää ennen odotettua kuukautisvuotta (26. päivänä 28 päivän kierron aikana). Tätä menetelmää käytetään tapauksissa, joissa diagnoosi on epäselvä. Endometriumin muutosten tutkimiseksi ns. "implantaatioikkunan" aikana tehdään koepala kuudentena päivänä ovulaation jälkeen.
Hoito
NLF:n diagnosoinnissa (peräsuolen lämpötilan mittausten mukaan toisen vaiheen kesto on alle 11 päivää, lämpötila nousee asteittain, endometriumin erittyminen on riittämätöntä endometriumin biopsiatietojen perusteella, progesteronin alhainen taso veressä), on tarpeen tunnistaa tällaisten häiriöiden syy.
Jos NLF:ään liittyy hyperprolaktinemiaa, tehdään aivojen magneettikuvaus. Vaihtoehtoinen menetelmä on kallon (turkinpään alueen) röntgenkuvaus.
Hyperprolaktinemian ensimmäinen vaihe on aivolisäkkeen adenooman poissulkeminen, joka vaatii kirurgista hoitoa. Jos merkittäviä muutoksia ei havaita, hyperprolaktinemiaa pidetään toiminnallisena, ja bromokriptiinihoito määrätään prolaktiinipitoisuuksien normalisoimiseksi. Bromokriptiinin aloitusannos on 1,25 mg/vrk kahden viikon ajan, prolaktiinipitoisuuksien seurannan jälkeen, jos indikaattorit eivät normalisoidu, annosta suurennetaan 2,5 mg:aan/vrk. Prolaktiinipitoisuuksien merkittävän nousun yhteydessä aloitusannos on 2,5 mg/vrk. Jos raskaus ilmenee, bromokriptiinihoito tulee lopettaa.
Jos kilpirauhasen vajaatoiminta havaitaan, kilpirauhasen patologian luonne määritetään yhdessä endokrinologin kanssa. Joka tapauksessa päivittäinen natriumlevotyroksiinihoito on aiheellista, ja annos valitaan yksilöllisesti, kunnes TSH-taso normalisoituu. Jos raskaus tapahtuu, natriumlevotyroksiinihoitoa tulee jatkaa. Annoksen nostamisen tarkoituksenmukaisuus raskauden ensimmäisen kolmanneksen aikana ratkaistaan yhdessä endokrinologin kanssa hormonaalisen tutkimuksen tulosten (TSH-taso, vapaa tyroksiini) jälkeen.
NLF:n korjaus suoritetaan kahdella tavalla. Ensimmäinen tapa on ovulaation stimulaatio, toinen tapa on korvaushoito progesteronivalmisteilla.
Ensimmäinen hoitovaihtoehto on ovulaation stimulointi klomifeenisitraatilla. Tämä hoitomenetelmä perustuu siihen, että useimmat luteaalivaiheen häiriöt ilmenevät kierron follikulaarisessa vaiheessa. Jatkuvasti alentuneet progesteronitasot toisessa vaiheessa ovat seurausta follikulogeneesin heikkenemisestä kierron ensimmäisessä vaiheessa. Tämä häiriö korjataan todennäköisemmin pienillä klomifeenisitraatin annoksilla follikulaarisen vaiheen alussa kuin määräämällä progesteronia kierron toisessa vaiheessa.
Ensimmäisessä syklissä klomifeenisitraatin annos on 50 mg/vrk kuukautiskierron 5.–9. päivänä. Tehoa seurataan peräsuolen lämpötilan mittauksella, progesteronitason mittauksella kierron toisessa vaiheessa tai dynaamisella ultraäänellä. Jos ovulaation stimulaation toisessa syklissä ei ole riittävää vaikutusta, klomifeenisitraatin annosta tulee suurentaa 100 mg:aan/vrk kierron 5.–9. päivänä. Ovulaation stimulaation kolmannessa syklissä suurin mahdollinen annos on 150 mg/vrk. Tällainen annoksen suurentaminen on mahdollista vain, jos lääke on hyvin siedetty (ei voimakasta kipua alavatsassa ja alaselässä eikä muita munasarjojen hyperstimulaation merkkejä).
Toinen hoitovaihtoehto: korvaushoito progesteronivalmisteilla, jotka edistävät kohdun limakalvon täydellistä sekretorista transformaatiota, mikä antaa tarvittavan vaikutuksen potilailla, joilla on tapana keskenmeno ja ovulaatio on säilynyt. Lisäksi viime vuosina on todettu, että progesteronivalmisteiden antamisella on paitsi hormonaalinen myös immunomodulatorinen vaikutus, joka estää immunokompetenttien solujen hylkimisreaktioita kohdun limakalvolla. Erityisesti samanlainen vaikutus on kuvattu dihydrogesteronille annoksella 20 mg/vrk. Korvaushoitona dydrogesteronia käytetään annoksella 20 mg/vrk suun kautta tai mikronisoitua progesteronia vaginaalisesti annoksella 200 mg/vrk. Hoito suoritetaan toisena päivänä ovulaation jälkeen (päivänä peräsuolen lämpötilan nousun jälkeen) ja sitä jatketaan 10 päivää. Jos raskaus tapahtuu, progesteronivalmisteilla hoitoa tulee jatkaa.
Nykyaikainen tutkimus ei ole vahvistanut ihmisen istukkagonadotropiinin tehokkuutta toistuvien keskenmenojen hoidossa.
Hyperandrogenismissa (munasarjojen tai lisämunuaisten synnyssä) potilailla, joilla on tavanomainen keskenmeno, lääkehoito on aiheellista androgeenien vaikutuksen vuoksi ovulaation täydellisyyteen ja kohdun limakalvon tilaan. Jos lisämunuaisten androgeenien biosynteesiä rikotaan, niiden virilisoiva vaikutus naispuoliseen sikiöön on mahdollinen, joten steroidihoito suoritetaan sikiön edun mukaisesti.
Munasarjojen hyperandrogenismi (monikystatiset munasarjat)
Anamneesi, lääkärintarkastus ja erikoistutkimusten tulokset
- Historia: myöhäiset kuukautiset, kuukautiskierron häiriöt, kuten oligomenorrea (yleensä primaarinen, harvemmin sekundaarinen). Raskaudet ovat harvinaisia, yleensä keskeyttävät itsensä itsestään ensimmäisen kolmanneksen aikana, ja raskauksien välillä on pitkiä hedelmättömyysjaksoja.
- Tutkimus: hirsutismi, akne, raskausarvet, korkea painoindeksi (valinnainen).
- Peräsuolen lämpötilakäyrät: anovulatoriset syklit vuorottelevat ovulaatio- ja NLF-syklien kanssa.
- Hormonaalitutkimus: korkeat testosteronitasot, FSH- ja LH-tasot voivat olla koholla, LH/FSH-suhde on yli 3. Ultraääni: monirakkulat munasarjat.
Hoito
Lääkkeetön hoito
Laihdutus - ruokavaliohoito, liikunta.
Lääkehoito
- Orlistaatti annoksella 120 mg jokaisen pääaterian yhteydessä. Kurssin kesto määritetään ottaen huomioon vaikutuksen ja siedettävyyden.
- Alustava testosteronin alentaminen syproteroniasetaattia (2 mg) ja etinyyliestradiolia (35 mikrog) sisältävillä valmisteilla kolmen kuukautiskierron ajan.
- Ehkäisyn lopettaminen, kierron toisen vaiheen hormonaalinen tuki (gestageenihoito) - dydrogesteroni annoksella 20 mg/vrk kuukautiskierron 16. päivästä 25. päivään. Jos spontaania ovulaatiota ei tapahdu, siirrytään seuraavaan vaiheeseen.
- Ovulaation stimulointi klomifeenisitraatilla aloitusannoksella 50 mg/vrk kuukautiskierron 5.–9. päivänä samanaikaisesti gestageenien (dydrogesteroni annoksella 20 mg/vrk syklin 16.–25. päivänä) ja deksametasonin (0,5 mg) kanssa.
- Raskauden puuttuessa klomifeenisitraatin annosta nostetaan 100–150 mg:aan päivässä antamalla gestageeneja kierron toisessa vaiheessa ja deksametasonia (0,5 mg). On todettu, että vaikka deksametasoni vähentää vain lisämunuaisten androgeenien määrää, ovulaatio ja hedelmöitys tapahtuvat merkittävästi useammin klomifeenisitraatilla ja deksametasonilla hoidettaessa kuin käytettäessä pelkästään klomifeenisitraattia [12].
- Ovulaation stimulaatiota suoritetaan kolme sykliä, minkä jälkeen suositellaan kolmen kuukautiskierron taukoa gestageenituella ja päätöstä kirurgisesta hoidosta laparoskooppisella menetelmällä (munasarjojen kiilaleikkaus, laserhöyrystys).
Potilaan jatkohoito
Raskauden hoitoon tulee liittää gestageeninen tukihoito 16. raskausviikkoon asti (dydrogesteroni annoksella 20 mg/vrk tai mikronisoitu progesteroni annoksella 200 mg/vrk). Deksametasonia määrätään vain raskauden ensimmäisen kolmanneksen aikana. Seuranta on pakollista istmoksen ja kohdunkaulan vajaatoiminnan oikea-aikaiseksi diagnosoimiseksi ja tarvittaessa sen kirurgiseksi korjaamiseksi.
Lisämunuaisten hyperandrogenismi (murrosiän ja murrosiän jälkeinen adrenogenitaalinen oireyhtymä)
Adrenogenitaalinen oireyhtymä (AGS) on perinnöllinen sairaus, johon liittyy lisämunuaisten kuoren hormonien synteesin häiriö useiden entsyymijärjestelmien synteesistä vastaavien geenien vaurioitumisen vuoksi. Tauti periytyy autosomaalisesti peittyvästi, jolloin mutanttigeenit siirtyvät molemmilta vanhemmilta, jotka ovat terveitä kantajia.
90 prosentissa tapauksista adrenogenitaalinen oireyhtymä johtuu CYP21B-geenin mutaatioista, jotka johtavat 21-hydroksylaasin synteesin häiriöihin.
Anamneesi, lääkärintarkastus ja erikoistutkimusten tulokset
- Historia: myöhäiset kuukautiset, hieman pitkittynyt kuukautiskierto, mahdollinen oligomenorrea, keskenmenot ensimmäisen kolmanneksen aikana, mahdollinen hedelmättömyys.
- Tutkimus: akne, hirsutismi, androidivartalotyyppi (leveät hartiat, kapea lantio), klitoriksen liikakasvu.
- Peräsuolen lämpötilakäyrät: anovulatoriset syklit vuorottelevat ovulaatio- ja NLF-syklien kanssa.
- Hormonitesti: korkea 17-OP, DHEAS.
- Ultraääni: munasarjat muuttumattomina.
Raskauden ulkopuolinen patognomoninen merkki on 17-OP:n pitoisuuden nousu veriplasmassa.
Tällä hetkellä lisämunuaisten hyperandrogenismin piilevän, ei-klassisen muodon diagnosoimiseksi käytetään ACTH-testiä. Tässä testissä käytetään Synacthenia, synteettistä polypeptidiä, jolla on endogeenisen ACTH:n ominaisuuksia eli se stimuloi steroidihormonien synteesin alkuvaiheita kolesterolista lisämunuaisissa.
Synacthen-testi (ACTH-analogi): 1 ml (0,5 mg) Synacthenia ruiskutetaan ihon alle olkapäähän. 17-OP:n ja kortisolin alkupitoisuus määritetään ensin aamulla otetusta 9 tunnin veriplasmanäytteestä. Kontrollina otetaan verinäyte 9 tuntia injektion jälkeen 17-OP:n ja kortisolin pitoisuuden määrittämiseksi. Määritysindeksi (D) lasketaan sitten kaavalla:
D = 0,052 × 17-OP + 0,005 × kortisoli/17-OP - 0,018 × kortisoli/17-OP
Jos D-kerroin on pienempi tai yhtä suuri kuin 0,069, se osoittaa, ettei lisämunuaisten hyperandrogenismia esiinny. Jos D-kerroin on yli 0,069, on katsottava, että hyperandrogenismi johtuu lisämunuaisten toimintahäiriöstä.
Lääkehoito
21-hydroksylaasin puutoksesta johtuvan hyperandrogenismin hoidon perusta on glukokortikoidit, joita käytetään estämään liiallista androgeenieritystä.
Potilaan jatkohoito
Äidin androgeenien virilisoivan vaikutuksen vuoksi sikiöön, kun lisämunuaisten hyperandrogenismi on todettu, deksametasonihoito aloitusannoksella 0,25 mg määrätään ennen raskautta ja sitä jatketaan yksilöllisesti valitulla annoksella (0,5–1 mg) koko raskauden ajan. Naisella, jolla on tavanomainen keskenmeno ja joka kärsii lisämunuaisten hyperandrogenismista, hoidon keskeyttäminen ei ole tarkoituksenmukaista, koska keskenmenojen esiintymistiheys ilman hoitoa on 14 % ja hoidon jatkuessa 9 %.
Koska adrenogenitaalioireyhtymää sairastavat potilaat voivat siirtää tämän geenin sikiölle, on tarpeen tehdä synnytystä edeltävä diagnoosi: 17–18 raskausviikolla määrätään verikoe äidin 17-OP-pitoisuuden määrittämiseksi. Jos hormonin pitoisuus veressä on kohonnut, sen pitoisuus lapsivedessä määritetään. Jos 17-OP-pitoisuus lapsivedessä on kohonnut, diagnosoidaan sikiöllä adrenogenitaalioireyhtymä. Valitettavasti adrenogenitaalioireyhtymän vakavuutta (lievä tai suolaa hukkaava vaikea muoto) ei voida määrittää lapsiveden 17-OP-pitoisuuden perusteella. Raskauden jatkumisesta tässä tilanteessa päättävät vanhemmat.
Jos lapsen isä on adrenogenitaalioireyhtymägeenin kantaja ja perheessä on esiintynyt tapauksia, joissa lapsilla on tämä oireyhtymä, potilas, vaikka hänellä ei olisi lisämunuaisten hyperandrogenismia, saa sikiön edun mukaisesti deksametasonia (naispuolisen sikiön virilisaation estämiseksi) annoksella 20 mikrog/kg ruumiinpainoa, enintään 1,5 mg/vrk 2-3 annoksessa aterioiden jälkeen. 17-18 viikolla, sikiön sukupuolen ja adrenogenitaalioireyhtymägeenin ilmentymisen määrittämisen jälkeen (lapsipunktion tulosten perusteella), hoitoa jatketaan raskauden loppuun asti, jos sikiö on tyttö, jolla on adrenogenitaalioireyhtymä. Jos sikiö on poika tai tyttö, jolla ei ole adrenogenitaalioireyhtymägeeniä, deksametasonihoito voidaan lopettaa.
Jos naisella, jolla on tavanomaista keskenmenoa, on lisämunuaisten hyperandrogenismi, deksametasonihoito suoritetaan koko raskauden ajan ja lopetetaan vasta synnytyksen jälkeen. Kolmantena päivänä synnytyksen jälkeen deksametasonin annosta pienennetään vähitellen (0,125 mg joka kolmas päivä), kunnes se lopetetaan kokonaan synnytyksen jälkeisenä aikana.
Sekaperäinen hyperandrogenismi (munasarjojen ja lisämunuaisten)
Anamneesi, lääkärintarkastus ja erikoistutkimusten tulokset
- Historia: myöhäiset kuukautiset, kuukautiskierron häiriöt, kuten oligomenorrea (yleensä primaarinen, harvemmin sekundaarinen), amenorrea, mahdolliset vammat, aivotärähdykset. Raskaudet ovat harvinaisia, yleensä keskeyttävät itsestään ensimmäisen kolmanneksen aikana, pitkiä hedelmättömyysjaksoja raskauksien välillä.
- Lääkärintarkastus: hirsutismi, akne, striat, mustat akantoosit, korkea painoindeksi, verenpainetauti.
- Peräsuolen lämpötilakäyrät: anovulatoriset syklit vuorottelevat ovulaatio- ja NLF-syklien kanssa.
- Hormonaalitutkimus: korkeat testosteronitasot, FSH- ja LH-tasot voivat olla koholla, LH/FSH-suhde yli 3, korkeat DHEAS-tasot, 17-OP-tasot, hyperprolaktinemiaa voi esiintyä.
- Ultraääni: monirakkulasoluanemia
- Elektroenkefalografia: aivojen biosähköisen aktiivisuuden muutokset.
- Hyperinsulinemia, rasva-aineenvaihdunnan häiriöt (korkea kolesteroli, matalatiheyksiset lipoproteiinit ja erittäin matalatiheyksiset lipoproteiinit), heikentynyt glukoosinsieto tai kohonneet verensokeritasot.
Hoito
Lääkkeetön hoito
Painonpudotus (vähäkalorinen ruokavalio, liikunta).
Lääkehoito
Ensimmäinen vaihe - insuliiniresistenssin läsnä ollessa on suositeltavaa määrätä metformiinia vuorokausiannoksella 1000-1500 mg insuliiniherkkyyden lisäämiseksi.
Toinen vaihe - vakavien kuukautiskierron häiriöiden ja korkeiden testosteronitasojen tapauksessa on suositeltavaa määrätä antiandrogeenista vaikutusta omaavia lääkkeitä, jotka sisältävät syproteroniasetaattia (2 mg) ja etinyyliestradiolia (35 mikrog) 3 kuukauden ajan.
Kolmas vaihe on ovulaation stimulointi, jota seuraa gestageeninen tuki (kaavio on kuvattu edellä) ja deksametasonin ottaminen vuorokausiannoksella 0,25–0,5 mg.
Hyperprolaktinemian ja kilpirauhasen vajaatoiminnan yhteydessä on tehtävä asianmukainen lääkekorjaus ovulaation stimulaatiosykleissä. Jos raskaus tapahtuu, bromokriptiinihoito on lopetettava ja levotyroksiinihoitoa jatkettava.
Jos ovulaation stimulaatio on tehotonta, on päätettävä suoran ovulaation indusoijan määräämisestä, polykystisten munasarjojen kirurgisen hoidon tai in vitro -hedelmöityksen tarkoituksenmukaisuudesta.
Potilaan jatkohoito
Metabolista oireyhtymää sairastavilla potilailla raskautta vaikeuttaa usein valtimoverenpainetauti, nefropatia ja hyperkoagulaatio, joiden yhteydessä on tarpeen seurata verenpainetta ja hemostasiogrammeja raskauden alkuvaiheista lähtien ja korjata syntyvät häiriöt (tarvittaessa) verenpainelääkkeillä, verihiutaleiden vastaisilla aineilla ja antikoagulanteilla. Progestageenilääkkeitä määrätään raskauden 16. viikkoon asti - didrogesteronia annoksella 20 mg / vrk tai mikronisoitua progesteronia annoksella 200 mg / vrk kahdessa annoksessa.
Kaikki hyperandrogenismia sairastavat naiset edustavat riskiryhmää lantionpohjan ja kohdunkaulan vajaatoiminnan kehittymiselle. Kohdunkaulan tilan seuranta tulee suorittaa 16. raskausviikosta alkaen, ja tarvittaessa lantionpohjan ja kohdunkaulan vajaatoiminta korjataan kirurgisesti.
Tavallisen keskenmenon immunologiset syyt
Tällä hetkellä tiedetään, että noin 80 % kaikista aiemmin selittämättömistä toistuvista keskenmenoista (kun geneettiset, anatomiset ja hormonaaliset syyt on suljettu pois) liittyy immuunijärjestelmän häiriöihin. Erotetaan autoimmuuni- ja alloimmuunisairauksia, jotka johtavat tavanomaiseen keskenmenoon.
Autoimmuuniprosesseissa immuunijärjestelmän omat kudokset joutuvat aggression kohteeksi eli immuunivaste kohdistuu sen omiin antigeeneihin. Tässä tilanteessa sikiö kärsii toissijaisesti äidin kudosten vaurioitumisen seurauksena.
Alloimmuunisairauksissa naisen immuunivaste kohdistuu isältä saatuihin alkion/sikiön antigeeneihin, jotka ovat mahdollisesti vieraita äidin elimistölle.
Tavanomaisesta keskenmenosta kärsivillä potilailla yleisimmin esiintyviin autoimmuunisairauksiin kuuluvat seerumin fosfolipidi-, kilpirauhasen vasta-aineet ja ydinvasta-aineet. On siis todettu, että 31 prosentilla raskauden ulkopuolisen tavallisen keskenmenon saaneista naisista on autovasta-aineita tyreoglobuliinille ja kilpirauhasperoksidaasille (kilpirauhasen mikrosomaaliset [kilpirauhasen peroksidaasi] -autovasta-aineet); näissä tapauksissa spontaanin keskenmenon riski raskauden ensimmäisen kolmanneksen aikana kasvaa 20 prosenttiin. Tavanomaisessa keskenmenossa ydin- ja kilpirauhasen vasta-aineiden esiintyminen viittaa lisätutkimusten tarpeeseen autoimmuuniprosessin tunnistamiseksi ja diagnoosin varmistamiseksi.
Antifosfolipidioireyhtymä (APS) on edelleen yleisesti tunnettu autoimmuunisairaus, joka johtaa alkion/sikiön kuolemaan.
Alloimmuunisairaudet
Tällä hetkellä sikiön hyljintään johtaviin alloimmuuniprosesseihin kuuluvat lisääntynyt (yli 3) määrä yhteisiä antigeenejä, jotka liittyvät merkittävään histoyhteensopivuuskompleksijärjestelmään puolisoilla (usein havaittu verisukulaisavioliitoissa); alhainen estotekijöiden taso äidin seerumissa; lisääntynyt luonnollisten tappajasolujen (NK-solut CD56, CD16) taso äidin kohdun limakalvolla ja ääreisveressä sekä raskauden ulkopuolella että sen aikana; useiden sytokiinien, erityisesti γ-interferonin, tuumorinekroositekijä a:n, interleukiini-1:n ja -2:n, korkea pitoisuus kohdun limakalvolla ja seerumissa.
Tällä hetkellä tutkitaan alloimmuunitekijöitä, jotka johtavat varhaisiin keskenmenoihin, ja keinoja näiden tilojen korjaamiseksi. Hoitomenetelmistä ei ole yksimielisyyttä. Joidenkin tutkijoiden mukaan aktiivinen immunisaatio luovuttajalymfosyyteillä ei tuota merkittävää vaikutusta, kun taas toiset kirjoittajat kuvaavat merkittävää positiivista vaikutusta tällaisella immunisaatiolla ja immunoglobuliineilla hoidolla.
Tällä hetkellä yksi raskauden alkuvaiheen immunomodulatorisista aineista on progesteroni. Erityisesti tutkimukset ovat osoittaneet dydrogesteronin roolin 20 mg:n vuorokausiannoksella naisilla, joilla on ollut tavallinen keskenmeno raskauden ensimmäisen kolmanneksen aikana ja kohonnut CD56-solujen määrä kohdun limakalvolla.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Geneettisesti määräytyneet trombofiliat
Seuraavia geneettisesti määräytyneiden trombofilioiden muotoja pidetään raskauden aikaisina trombofiilisinä tiloina, jotka johtavat tavanomaiseen keskenmenoon.
- Antitrombiini III:n puutos.
- Tekijä V -mutaatio (Leiden-mutaatio).
- Proteiini C:n puutos.
- Proteiini S:n puutos.
- Protrombiinigeenin mutaatio G20210A.
- Hyperhomokysteinemia.
Harvinaisten trombofilian syiden tunnistamiseksi tehtävä tutkimus on tarpeen tapauksissa, joissa oli:
- sukuhistoria - tromboembolia ennen 40 vuoden ikää sukulaisilla;
- luotettavat laskimo- ja/tai valtimotromboositapaukset ennen 40 vuoden ikää;
- toistuva tromboosi potilaalla ja lähisukulaisilla;
- tromboemboliset komplikaatiot raskauden aikana ja synnytyksen jälkeen hormonaalista ehkäisyä käytettäessä;
- toistuvat keskenmenot, kohtukuolemat, kohdunsisäinen kasvun hidastuminen, istukan irtoaminen;
- varhainen raskausmyrkytys, HELLP-oireyhtymä.
Tavallisen keskenmenon tarttuvat syyt
Tartuntatekijän roolista tavanomaisen keskenmenon aiheuttajana keskustellaan parhaillaan laajalti. Tiedetään, että raskauden alkuvaiheessa saatu primaaritartunta voi aiheuttaa alkiolle elämän kanssa yhteensopimattomia vaurioita, jotka johtavat satunnaiseen keskenmenoon. Tartunnan uudelleen aktivoitumisen todennäköisyys samanaikaisesti toistuvien keskenmenojen kanssa on kuitenkin merkityksetön. Lisäksi tavanomaista keskenmenoa aiheuttavia mikro-organismeja ei ole tällä hetkellä löydetty. Viime vuosina tehdyt tutkimukset ovat osoittaneet, että useimmilla naisilla, joilla on tavanomaista keskenmenoa ja krooninen kohdun limakalvontulehdus, esiintyy kohdun limakalvolla 2–3 tai useampaa obligaattista anaerobista mikro-organismia ja virusta.
V. M. Sidelnikovan ym. mukaan naisilla, jotka kärsivät tavanomaisesta keskenmenosta, kroonisen endometriitin diagnoosi raskauden ulkopuolella varmistettiin histologisesti 73,1 %:ssa tapauksista ja 86,7 %:ssa havaittiin opportunististen mikro-organismien pysyvyyttä kohdun limakalvolla, mikä voi varmasti olla immunopatologisten prosessien aktivoitumisen syy. Sekalaista pysyvää virusinfektiota (herpes simplex -virus, Coxsackie A, Coxsackie B, enterovirukset 68–71, sytomegalovirus) esiintyy potilailla, joilla on tavallinen keskenmeno, huomattavasti useammin kuin naisilla, joilla on normaali synnytyshistoria. K. Kohut ym. (1997) osoittivat, että tulehduksellisten muutosten prosenttiosuus kohdun limakalvolla ja desiduakudoksessa potilailla, joilla on primaarinen toistuva keskenmeno, on merkittävästi suurempi kuin naisilla keskenmenon jälkeen, joilla on ollut vähintään yksi täysiaikainen synnytys.
Bakteerien ja virusten aiheuttama kohdun limakalvon kolonisaatio johtuu yleensä immuunijärjestelmän ja elimistön epäspesifisten suojavoimien (komplementtijärjestelmä, fagosytoosi) kyvyttömyydestä eliminoida tartunnanaiheuttajaa kokonaan, ja samalla sen leviämistä rajoittaa T-lymfosyyttien (T-auttajat, luonnolliset tappajasolut) ja makrofagien aktivoituminen. Kaikissa edellä mainituissa tapauksissa mikro-organismien pysyvyys ilmenee, jolle on ominaista mononukleaaristen fagosyyttien, luonnollisten tappajasolujen, T-auttajasolujen, jotka syntetisoivat erilaisia sytokiineja, vetäminen kroonisen tulehduksen kohtaan. Ilmeisesti tällainen kohdun limakalvon tila estää paikallisen immunosuppression syntymisen preimplantaatiovaiheessa, mikä on välttämätöntä suojaesteen muodostamiseksi ja puoliksi vieraan sikiön hyljinnän estämiseksi.
Tässä suhteessa ennen raskautta naisille, joilla on toistuva keskenmeno, tulisi diagnosoida krooninen endometriumtulehdus. Tämän diagnoosin toteamiseksi tai poissulkemiseksi tehdään endometriumbiopsia kuukautiskierron 7.-8. päivänä, ja lisäksi tehdään histologinen tutkimus, PCR ja bakteriologinen tutkimus kohdun ontelosta otetusta näytteestä. Diagnoosin varmentamiseksi kroonista endometriumitulehdusta hoidetaan lantion elinten tulehdussairauksien hoitostandardien mukaisesti.

