Lääketieteen asiantuntija
Uudet julkaisut
B-hepatiitin patogeneesi
Viimeksi tarkistettu: 07.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Hepatiitti B:n patogeneesissä voidaan tunnistaa useita patogeneettisen ketjun johtavia linkkejä:
- taudinaiheuttajan käyttöönotto - infektio;
- kiinnittyminen maksasoluun ja tunkeutuminen soluun;
- viruksen lisääntyminen ja sen "työntyminen ulos" maksasolujen pinnalle sekä vereen;
- immunologisten reaktioiden aktivointi taudinaiheuttajan poistamiseksi;
- immuunikompleksin vauriot elimille ja järjestelmille;
- immuniteetin muodostuminen, taudinaiheuttajan vapautuminen, toipuminen.
Koska hepatiitti B -infektio tapahtuu aina parenteraalisesti, voidaan olettaa, että tartuntahetki on käytännössä sama kuin viruksen tunkeutuminen vereen. Joidenkin tutkijoiden yritykset erottaa hepatiitti B:n enteraalinen ja alueellinen vaihe ovat huonosti perusteltuja. On enemmän perusteita uskoa, että virus pääsee välittömästi maksaan verenkierron mukana.
Hepatiitti B -viruksen tropismi maksakudoksessa määräytyy HBsAg:ssä olevan erityisen reseptorin perusteella – polypeptidin, jonka molekyylipaino on 31 000 Da (P31) ja jolla on albumiinia sitova aktiivisuus. Samanlainen albumiinivyöhyke löytyy myös ihmisen ja simpanssin maksasolujen kalvoilta, mikä olennaisesti määrää HBV:n tropismin ihmisen ja simpanssin maksaan.
Kun virus tunkeutuu maksasoluun, vapautuu viruksen DNA:ta, joka tunkeutuessaan maksasolun tumaan ja toimiessaan matriisina nukleiinihappojen synteesille laukaisee sarjan peräkkäisiä biologisia reaktioita, joiden tuloksena viruksen nukleokapsidi kootaan. Nukleokapsidi kulkeutuu tumakalvon läpi sytoplasmaan, jossa tapahtuu Dane-hiukkasten - täydellisen hepatiitti B -viruksen - lopullinen kooaminen.
On kuitenkin huomattava, että kun maksasolu on infektoitunut, prosessi voi edetä kahdella tavalla - replikatiivisesti ja integratiivisesti. Ensimmäisessä tapauksessa kehittyy kuva akuutista tai kroonisesta hepatiitista ja toisessa - viruksen kantajuudesta.
Syitä, jotka määräävät virus-DNA:n ja maksasolujen välisen kahden vuorovaikutustyypin, ei ole tarkalleen selvitetty. Todennäköisesti vasteen tyyppi on geneettisesti määräytynyt.
Replikatiivisen vuorovaikutuksen tuloksena ydinantigeenirakenteiden kokoaminen (ytimessä) ja täydellisen viruksen kokoaminen (sytoplasmassa), jota seuraa täydellisen viruksen tai sen antigeenien esittely kalvolla tai maksasolukalvon rakenteessa.
Yleisesti hyväksytään, että viruksen replikaatio ei johda soluvaurioihin maksasolutasolla, koska hepatiitti B -viruksella ei ole sytopaattista vaikutusta. Tätä kantaa ei voida pitää kiistattomana, koska se perustuu kokeellisiin tietoihin, jotka, vaikka ne osoittavatkin hepatiitti B -viruksen sytopaattisen vaikutuksen puuttumisen, on saatu kudosviljelmillä, eikä niitä siksi voida täysin ekstrapoloida virushepatiitti B:hen ihmisillä. Joka tapauksessa kysymys maksasolujen vaurioiden puuttumisesta replikaatiovaiheen aikana vaatii lisätutkimuksia.
Viruksen ja solun vuorovaikutuksen luonteesta riippumatta maksa on kuitenkin välttämättä mukana immunopatologisessa prosessissa. Tässä tapauksessa maksasolujen vaurio liittyy siihen, että virusantigeenien ilmentymisen seurauksena maksasolukalvolla ja virusantigeenien vapautumisen vapaaseen verenkiertoon seurauksena käynnistyy peräkkäisten solu- ja humoraalisten immuunireaktioiden ketju, jonka tarkoituksena on lopulta poistaa virus kehosta. Tämä prosessi suoritetaan täysin virusinfektioiden immuunivasteen yleisten mallien mukaisesti. Patogeenin eliminoimiseksi käytetään solusytotoksisia reaktioita, joita välittävät eri efektorisolujen luokat: K-solut, T-solut, luonnolliset tappajat ja makrofagit. Näiden reaktioiden aikana infektoituneet maksasolut tuhoutuvat, jolloin vapautuu virusantigeenejä (HBcAg, HBeAg, HBsAg), jotka käynnistävät vasta-aineiden muodostumisjärjestelmän, minkä seurauksena vereen kertyy spesifisiä vasta-aineita, pääasiassa ydintä vastaan - anti-HBc ja e-antigeeni - anti-HBE. Näin ollen maksasolun vapautuminen viruksesta tapahtuu sen kuoleman prosessissa solun sytolyysin reaktioiden vuoksi.
Samanaikaisesti vereen kertyvät spesifiset vasta-aineet sitoutuvat virusantigeeneihin muodostaen makrofagien fagosytoimia immuunikomplekseja, jotka erittyvät munuaisten kautta. Tässä tapauksessa voi esiintyä erilaisia immuunikompleksivaurioita, kuten glomerulonefriittia, arteriittia, nivelkipua, ihottumia jne. Spesifisten vasta-aineiden osallistumisella keho puhdistuu taudinaiheuttajasta ja täydellinen toipuminen tapahtuu.
Hepatiitti B:n patogeneesin hahmotellun käsitteen mukaisesti kaikki taudin kulun kliinisten varianttien monimuotoisuus selitetään yleensä viruksen vuorovaikutuksen ja immunokompetenttien solujen yhteistyön erityispiirteillä, toisin sanoen immuunivasteen voimakkuudella virusantigeenien läsnäoloon. Nykyaikaisten käsitysten mukaan immuunivasteen voimakkuus on geneettisesti määräytynyt ja liittyy ensimmäisen luokan HLA-lokuksen histoyhteensopivuusantigeeneihin.
Yleisesti hyväksytään, että virusantigeeneille annetun riittävän immuunivasteen vallitessa akuutti hepatiitti kehittyy kliinisesti syklisellä kurssilla ja täydellisellä toipumisella. Virusantigeeneille annetun immuunivasteen heikkenemisen taustalla immuunivälitteinen sytolyysi ilmenee merkityksettömästi, joten infektoituneiden maksasolujen tehokasta eliminaatiota ei tapahdu, mikä johtaa lieviin kliinisiin oireisiin ja viruksen pitkäaikaiseen pysyvyyteen sekä mahdollisesti kroonisen hepatiitin kehittymiseen. Samaan aikaan päinvastoin, geneettisesti määräytyvän voimakkaan immuunivasteen ja massiivisen infektion (hemotransfuusion) tapauksessa syntyy laajoja maksasoluvaurioalueita, jotka vastaavat kliinisesti taudin vakavia ja pahanlaatuisia muotoja.
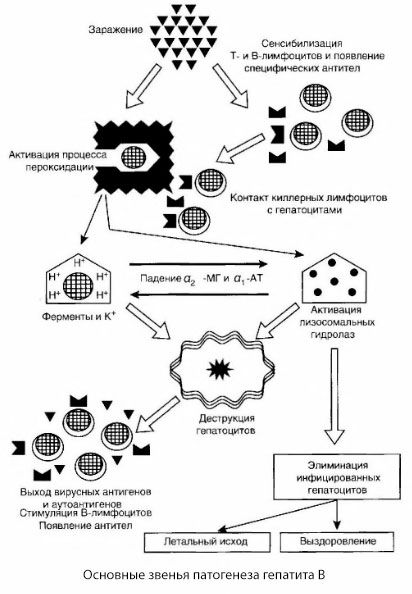
Esitetty hepatiitti B:n patogeneesikaavio erottuu johdonmukaisuudestaan, mutta se sisältää useita kiistanalaisia ja huonosti tutkittuja kohtia.
Jos hepatiitti B:tä pidetään immunopatologisena sairautena, voimme odottaa solujen sytotoksisuusreaktioiden lisääntymistä taudin vaikeusasteen kasvaessa. Vaikeissa muodoissa soluimmuniteetin indeksit kuitenkin laskevat jyrkästi, jopa moninkertainen lasku, verrattuna terveisiin lapsiin, sekä K-solujen sytotoksisuusindeksi. Pahanlaatuisessa muodossa, massiivisen maksanekroosin ja erityisesti maksakooman kehittymisen aikana, havaitaan lymfosyyttien täydellinen kyvyttömyys blastitransformaatioon fytohemattlutiniinin, stafylokokki-endotoksiinin ja HBsAg:n vaikutuksesta. Lisäksi leukosyytit eivät kykene migraamaan leukosyyttien migraation estoreaktion (LMIC) mukaisesti, ja fluoresoivalla tetrasykliinikoettimella tehtyjen tutkimusten tulosten mukaan lymfosyyttikalvojen läpäisevyys kasvaa jyrkästi.
Jos siis terveillä ihmisillä lymfosyyttien fluoresenssi-indeksit ovat 9,9 ± 2 % ja tyypillisessä hyvänlaatuisessa hepatiitti B:ssä ne nousevat 22,3 ± 2,7 %:iin, niin pahanlaatuisissa muodoissa fluoresoivien lymfosyyttien määrä on keskimäärin 63,5 ± 5,8 %. Koska solukalvojen läpäisevyyden lisääntymistä pidetään kirjallisuudessa yksiselitteisesti luotettavana indikaattorina niiden toiminnallisesta alemmuudesta, voidaan päätellä, että hepatiitti B:ssä, erityisesti pahanlaatuisessa muodossa, lymfosyyteille aiheutuu vakavia vaurioita. Tämän osoittavat myös K-solujen sytotoksisuuden indeksit. Vaikeassa muodossa, taudin 1.–2. viikolla, sytotoksisuus on 15,5 ± 8,8 %, pahanlaatuisessa muodossa ensimmäisellä viikolla 6,0 ± 2,6 ja toisella viikolla 22,0 ± 6,3 %, normaaliarvon ollessa 44,8 ± 2,6 %.
Esitetyt tiedot osoittavat selvästi merkittäviä häiriöitä immuniteetin soluyhteydessä potilailla, joilla on vaikea hepatiitti B -muoto. On myös ilmeistä, että nämä muutokset tapahtuvat toissijaisesti myrkyllisten metaboliittien ja mahdollisesti kiertävien immuunikompleksien vaurioiden seurauksena immunokompetenteille soluille.
Kuten tutkimukset ovat osoittaneet, potilailla, joilla on vaikea hepatiitti B -muoto, erityisesti massiivisen maksanekroosin kehittyessä, HBsAg:n ja HBeAg:n tiitteri veriseerumissa pienenee ja samanaikaisesti pinta-antigeenin vasta-aineita alkaa havaita korkeina tiittereinä, mikä on täysin epätyypillistä taudin hyvänlaatuisille muodoille, joissa anti-HBV:tä esiintyy vasta taudin 3.-5. kuukaudella.
Hepatiitti B -virusantigeenien nopea katoaminen samanaikaisesti korkeiden antiviraalisten vasta-aineiden tiitterien ilmaantumisen kanssa viittaa immuunikompleksien intensiiviseen muodostumiseen ja niiden mahdolliseen osallistumiseen massiivisen maksanekroosin kehittymisen patogeneesiin.
Näin ollen tosiseikat eivät salli hepatiitti B:n yksiselitteistä tulkintaa pelkästään immunopatologisen aggression näkökulmasta. Eikä kyse ole vain siitä, ettei maksan morfologisten muutosten syvyyden ja esiintyvyyden ja toisaalta soluimmuniteettitekijöiden vakavuuden välillä löydetä yhteyttä. Teoriassa tämä seikka voitaisiin selittää soluimmuniteetti-indikaattoreiden tutkimuksen myöhäisillä vaiheilla, kun immunokompetentit solut altistettiin voimakkaille toksisille vaikutuksille maksan lisääntyvän toiminnallisen vajaatoiminnan vuoksi. Voidaan tietysti olettaa, että maksasolujen immuunisytolyysi tapahtuu infektioprosessin varhaisimmassa vaiheessa, mahdollisesti jopa ennen vakavan maksavaurion kliinisten oireiden ilmaantumista. Tällainen oletus on kuitenkin epätodennäköinen, koska vastaavia soluimmuniteetin indikaattoreita havaittiin potilailla, joilla oli taudin akuutein (salamanlyönti) kulku, ja lisäksi maksakudoksen morfologisessa tutkimuksessa ei havaittu massiivista lymfosyyttistä infiltraatiota, kun taas samanaikaisesti havaittiin jatkuvia nekroottisen epiteelin kenttiä ilman resorptiota ja lymfosyyttistä aggressiota.
Akuutin hepatiitin morfologista kuvaa on erittäin vaikea selittää pelkästään immuunisolujen sytolyysin näkökulmasta, joten varhaisissa tutkimuksissa hepatiitti B -viruksen sytotoksista vaikutusta ei suljettu pois.
Tällä hetkellä tämä oletus on osittain vahvistettu hepatiitti B -viruksen löytämisen myötä. Kuten tutkimukset ovat osoittaneet, hepatiitti D -merkkiaineiden havaitsemistiheys riippuu suoraan taudin vakavuudesta: lievissä muodoissa niitä havaitaan 14 %:lla, kohtalaisessa 18 %:lla, vaikeassa 30 %:lla ja pahanlaatuisessa 52 %:lla potilaista. Ottaen huomioon, että hepatiitti D -viruksella on nekrosogeeninen sytopaattinen vaikutus, voidaan katsoa todeksi, että hepatiitti B- ja D-virusten yhteisinfektiolla on suuri merkitys hepatiitti B:n fulminanttien muotojen kehittymisessä.
Hepatiitti B:n patogeneesi voidaan esittää seuraavasti. Kun hepatiitti B -virus on tunkeutunut maksasoluihin, T-tappajat käynnistävät immunologisen hyökkäyksen infektoituneita maksasoluja vastaan ja erittävät lymfotoksiinia maksasolujen suuntaan.
Hepatiitti B:n maksasolujen vaurioiden tarkkoja mekanismeja ei ole vielä selvitetty. Johtavassa roolissa ovat aktivoituneet lipidiperoksidaatio- ja lysosomaalisten hydrolaasien prosessit. Laukaiseva tekijä voi olla efektorisoluista vapautuvat lymfotoksiinit niiden joutuessa kosketuksiin maksasolujen kanssa, mutta on mahdollista, että virus itse toimii peroksidaatioprosessien käynnistäjänä. Tämän jälkeen patologinen prosessi kehittyy todennäköisimmin seuraavassa järjestyksessä.
- Aggressiivisen tekijän (lymfotoksiinien tai viruksen) vuorovaikutus biologisten makromolekyylien kanssa (mahdollisesti endoplasmisen retikulumin kalvojen komponenttien kanssa, jotka kykenevät osallistumaan vieroitusprosesseihin, analogisesti muiden vahingollisten aineiden kanssa, kuten hiilitetrakloridin yhteydessä osoitettiin).
- Vapaiden radikaalien muodostuminen, lipidiperoksidaatioprosessien aktivoituminen ja kaikkien maksasolukalvojen lisääntynyt läpäisevyys (sytolyysioireyhtymä).
- Biologisesti aktiivisten aineiden liikkuminen pitoisuusgradienttia pitkin - erilaisten solunsisäisten lokalisaatioiden entsyymien, energianluovuttajien, kaliumin jne. menetys. Natriumin ja kalsiumin kertyminen soluihin, pH:n muutos kohti solunsisäistä asidoosia.
- Lysosomaalisten hydrolaasien (RNAse, DNAse, katepsiinit jne.) aktivointi ja vapautuminen maksasolujen hajoamisen ja autoantigeenien vapautumisen myötä.
- T- ja B-immuunijärjestelmien stimulointi T-lymfosyyttien spesifisen herkistymisen muodostumisella maksan lipoproteiinille sekä antihepaattisten humoraalisten autovasta-aineiden muodostumisella.
Ehdotetussa hepatiitti B:n patogeneesin järjestelmässä laukaisevana tekijänä toimivat virusantigeenit, joiden intensiivistä tuotantoa havaitaan taudin varhaisimmissa vaiheissa ja koko akuutin ajanjakson ajan, lukuun ottamatta pahanlaatuisia muotoja, joissa virusantigeenien tuotanto käytännössä loppuu massiivisen maksanekroosin kehittymisen aikaan, mikä määrää viruksen replikaation nopean vähenemisen.
On myös ilmeistä, että virusantigeenit aktivoivat immuniteetin T- ja B-järjestelmät. Tämän prosessin aikana tapahtuu T-lymfosyyttien alaryhmien tyypillinen uudelleenjakautuminen, jonka tarkoituksena on järjestää riittävä immuunivaste, eliminoida tartunnan saaneet maksasolut, neutraloida virusantigeenit, synnyttää sanogeneesiä ja toipua.
Kun immunokompetentit solut ovat vuorovaikutuksessa virusantigeenien kanssa maksasolujen kalvoilla tai viruksen lisääntymisen aikana maksasolujen sisällä, syntyy olosuhteet lipidiperoksidaatioprosessien aktivoitumiselle, joka, kuten tiedetään, säätelee kaikkien solu- ja subsellulaaristen kalvojen läpäisevyyttä.
Tästä näkökulmasta sytolyysioireyhtymän esiintyminen, solukalvojen lisääntynyt läpäisevyys, joka on niin luonnollinen ja erittäin tyypillinen virushepatiitille, tulee ymmärrettäväksi.
Sytolyysioireyhtymän lopputuloksena voi olla oksidatiivisen fosforylaation täydellinen irtoaminen, solumateriaalin vuotaminen ja maksan parenkyymin kuolema.
Valtaosassa tapauksista nämä prosessit eivät kuitenkaan kehity niin kohtalokkaasti. Vain taudin pahanlaatuisissa muodoissa patologinen prosessi etenee lumivyörymäisesti ja peruuttamattomasti, koska esiintyy massiivista infektiota, voimakasta immuuniprosessia, peroksidaatioprosessien ja lysosomaalisten hydrodaasien liiallista aktivoitumista sekä autoimmuunisairauksien aggressioilmiöitä.
Samat mekanismit havaitaan hepatiitti B:n suotuisassa kulussa, ainoana erikoisuutena on, että ne kaikki toteutuvat laadullisesti eri tasolla. Toisin kuin massiivisen maksanekroosin tapauksissa, taudin suotuisassa kulussa infektoituneiden maksasolujen määrä ja siten immunopatologisen sytolyysin vyöhyke on pienempi, lipidiperoksidaatioprosessit eivät ole yhtä merkittävästi tehostuneet, happohydrolaasien aktivaatio johtaa vain rajoitettuun autolyysiin ja merkityksettömään autoantigeenien vapautumiseen, ja siksi ilman massiivista autoaggressiota, eli kaikki patogeneesin vaiheet suotuisassa kulussa suoritetaan maksan parenkyymin säilyneen rakenteellisen organisaation puitteissa ja niitä rajoittavat puolustusjärjestelmät (antioksidantit, inhibiittorit jne.), eivätkä ne siksi ole niin tuhoisaa vaikutusta.
Virushepatiitin myrkytysoireiden syitä ei ole täysin tutkittu. Ehdotusta erottaa niin sanottu primaarinen eli virusperäinen myrkytys sekundaarisesta (vaihto- eli metabolinen) myrkytyksestä voidaan pitää myönteisenä, vaikka se ei paljastakaan yleisen toksisen oireyhtymän esiintymisen tarkkaa mekanismia. Ensinnäkin hepatiittiviruksilla ei ole toksisia ominaisuuksia, ja toiseksi monien metaboliittien pitoisuus ei aina korreloi taudin vakavuuden ja toksikoosin oireiden ilmentymisasteen kanssa. On myös tunnettua, että virusantigeenien pitoisuus ei korreloi tarkasti myrkytysasteen kanssa. Päinvastoin, taudin vakavuuden kasvaessa ja siten toksikoosin asteen kasvaessa HBsAg:n pitoisuus laskee ja on pienimmillään pahanlaatuisissa muodoissa syvän maksakooman alkaessa. Samalla spesifisten antiviraalisten vasta-aineiden havaitsemistiheys ja tiitterit riippuvat suoraan taudin vakavuudesta.
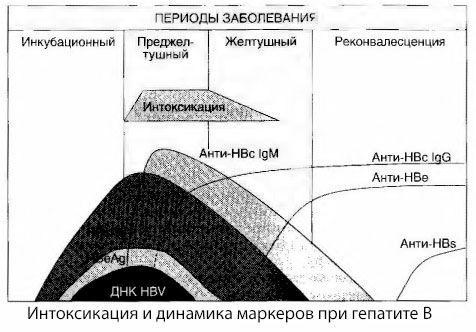
Myrkytys ei ilmene virusantigeenien rekisteröintihetkellä, vaan lehmän antigeeniin ja E-järjestelmän antigeeniin liittyvien IgM-luokan antiviraalisten vasta-aineiden verenkierrossa. Lisäksi vakavissa ja erityisesti pahanlaatuisissa muodoissa merkittävällä osalla potilaista on jopa anti-HB-vasta-aineita veressä, mitä ei yleensä koskaan havaita lievissä ja kohtalaisissa taudin muodoissa.
Esitetyt tiedot antavat meille mahdollisuuden päätellä, että virushepatiitin ja erityisesti hepatiitti B:n toksikoosioireyhtymä ei johdu virusantigeenien esiintymisestä veressä, vaan on seurausta virusantigeenien vuorovaikutuksesta IgM-luokan antiviraalisten vasta-aineiden kanssa. Tällaisen vuorovaikutuksen tuloksena, kuten tiedetään, muodostuu immuunikomplekseja ja mahdollisesti aktiivisia myrkyllisiä aineita.
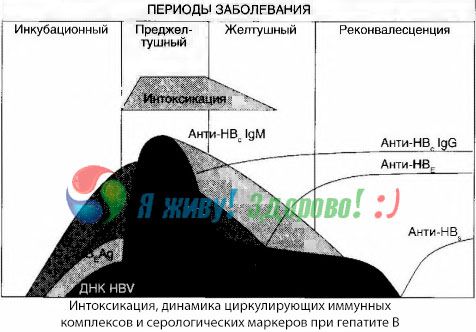
Myrkytyksen oireet ilmenevät immuunikompleksien ilmaantuessa vapaaseen verenkiertoon, mutta myöhemmin tällaista korrelaatiota ei havaita.
Osittainen selitys tälle löytyy immuunikompleksien koostumuksen tutkimuksesta. Vaikeissa muodoissa olevilla potilailla veressä kiertää pääasiassa keskikokoisia komplekseja, ja niiden koostumuksessa toksisen oireyhtymän huipulla luokan vasta-aineet ovat vallitsevia, kun taas kliinisten oireiden heikkenemisen ja toipumisvaiheen aikana kompleksit suurenevat ja niiden koostumuksessa IgG-luokan vasta-aineet alkavat vallita.
Esitetyt tiedot koskevat myrkyllisen oireyhtymän kehittymismekanismeja taudin alkuvaiheessa, mutta kliinisten oireiden pahimmassa vaiheessa esiintyvässä toksikoosissa niillä on vain osittainen merkitys, erityisesti maksakooman kehittymisessä.
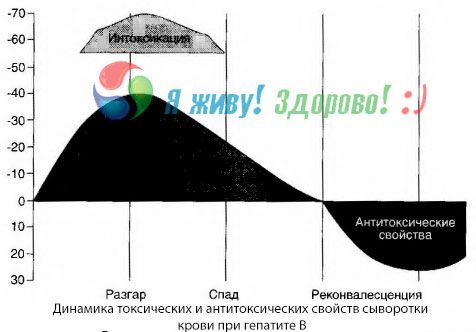
Veriviljelymenetelmä on osoittanut, että hepatiitti B:ssä vereen kertyy jatkuvasti toksiineja, jotka vapautuvat vaurioituneesta, hajoavasta maksakudoksesta. Näiden toksiinien pitoisuus on verrannollinen taudin vakavuuteen, ne ovat proteiiniluonteisia.
Toipumisjakson aikana veressä näkyy vasta-aineita tälle toksiinille, mutta maksakooman sattuessa toksiinin pitoisuus veressä nousee jyrkästi, eikä veressä havaita vasta-aineita.
Hepatiitti B:n patomorfologia
Morfologisten muutosten luonteen perusteella erotetaan kolme akuutin hepatiitti B:n muotoa:
- syklinen muoto,
- massiivinen maksanekroosi;
- kolestaattinen perikolangiolyyttinen hepatiitti.
Syklisessä hepatiitti B:n muodossa dystrofiset, tulehdukselliset ja proliferatiiviset muutokset ovat selvempiä lohkojen keskellä, kun taas hepatiitti A:ssa ne lokalisoituvat lohkon reunoille ja leviävät keskustaan. Nämä erot selittyvät viruksen erilaisilla tunkeutumisreiteillä maksakudokseen. Hepatiitti A -virus pääsee maksaan porttilaskimon kautta ja leviää lohkojen keskustaan, hepatiitti B -virus tunkeutuu maksavaltimon ja kapillaarihaarojen läpi, jotka syöttävät verta tasaisesti kaikkiin lohkoihin aina niiden keskustaan asti.
Maksan parenkyymin vaurioaste vastaa useimmissa tapauksissa taudin kliinisten ilmenemismuotojen vakavuutta. Lievissä muodoissa havaitaan yleensä maksasolujen fokaalista nekroosia, ja kohtalaisissa ja vaikeissa muodoissa - vyöhykkeellistä nekroosia (jolla on taipumus yhdistyä ja muodostaa sillan kaltaista nekroosia taudin vakavissa muodoissa).
Parenkyymin suurimmat morfologiset muutokset havaitaan kliinisten oireiden huipulla, mikä yleensä osuu samaan aikaan taudin ensimmäisen vuosikymmenen kanssa. Toisen ja erityisesti kolmannen vuosikymmenen aikana regeneraatioprosessit tehostuvat. Tähän mennessä nekrobioottiset muutokset häviävät lähes kokonaan ja solujen infiltraatioprosessit alkavat vallita, minkä jälkeen maksasolulevyjen rakenne palautuu hitaasti. Maksan parenkyymin rakenteen ja toiminnan täydellinen palautuminen tapahtuu kuitenkin vasta 3–6 kuukautta taudin alkamisen jälkeen, eikä kaikilla potilailla.
Hepatiitti B:n infektion yleistynyt luonne vahvistetaan HBsAg:n havaitsemisella paitsi maksasoluissa, myös munuaisissa, keuhkoissa, pernassa, haimassa, luuytimen soluissa jne.
Kolestaattinen (perikolangiolyyttinen) hepatiitti on taudin erityinen muoto, jossa suurimmat morfologiset muutokset havaitaan intrahepaattisissa sappitiehyissä, ja sille on ominaista kolangioliitti ja perikolangioliitti. Kolestaattisessa muodossa kolestaasia esiintyy sappisuonten laajentuessa ja sappinesteen pysähtyessä niissä, kolangiolien ja niiden ympärillä olevien soluinfiltraattien lisääntyessä. Maksasolut vaurioituvat tässä hepatiittimuodossa vain vähän. Kliinisesti taudille on ominaista pitkittynyt kulku ja pitkittynyt keltaisuus. On osoitettu, että tällaisen erikoisen taudinkulun syynä on viruksen vallitseva vaikutus kolangiolien seinämiin, mutta maksasoluihin se vaikuttaa vain vähän.

