Avainproteiini, joka on tunnistettu estämään luukatoa osteoporoosissa
Viimeksi tarkistettu: 14.06.2024

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
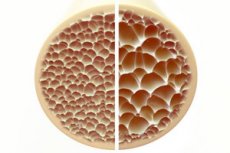
Osteoporoosi, sairaus, jolle on tunnusomaista huokoiset ja hauraat luut, on merkittävä uhka luuston terveydelle. Luut, jotka ovat ihmiskehon tärkein rakenteellinen tuki, tarjoavat elintärkeää tukea. Kun luumassa vähenee, se ei vain heikennä tätä tukea, vaan heikentää myös yleistä toimintaa, mikä heikentää elämänlaatua.
Kun osteoporoosin ilmaantuvuus lisääntyy ikääntyvän väestön keskuudessa, terveydenhuollon pitkäaikaishoidon resurssien kuormitus kasvaa. Siksi on välttämätöntä ymmärtää osteoporoosin kehittymistä edistävät mekanismit ja kehittää tehokkaita kohdennettuja hoitoja sen pitkäaikaisten vaikutusten minimoimiseksi.
Osteoblastit ja osteoklastit ovat kahden tyyppisiä soluja, joilla on keskeinen rooli luukudoksen ylläpidossa ja uudistamisessa. Vaikka osteoblastit ovat luuta muodostavia soluja ja vastaavat uuden luukudoksen synteesistä ja kerrostumisesta, osteoklastit ovat luuta hajottavia soluja, jotka osallistuvat vanhan tai vaurioituneen luukudoksen hajoamiseen ja poistamiseen.
Osteoklastien osuuden kasvu johtaa luun menettämiseen sellaisissa tiloissa kuin osteoporoosi, nivelreuma (niveltulehdus) ja luumetastaasit (luustoon levinnyt syöpä). Osteoklastit syntyvät makrofagien tai monosyyttien, jotka ovat immuunisolutyyppejä, erilaistumisesta.
Osteoklastien erilaistumisen estäminen voi siten toimia terapeuttisena strategiana luukadon estämiseksi. Tarkat molekyylimekanismit, jotka säätelevät monimutkaista luun uudelleenmuotoilua, ovat kuitenkin epäselviä.
Uudessa tutkimuksessa professori Tadayoshi Hayata, herra Takuto Konno ja rouva Hitomi Murachi Tokion tiedeyliopistosta yhdessä kollegoidensa kanssa syventyivät osteoklastien erilaistumisen molekyylisääntelyyn. Reseptorin ydintekijän kappa B -aktivaattoriligandin (RANKL) aiheuttama stimulaatio indusoi makrofagien erilaistumista osteoklasteiksi.
Lisäksi luun morfogeneettinen proteiini (BMP) ja transformoiva kasvutekijä (TGF)-β-signalointireitit ovat osallisina RANKL-välitteisen osteoklastien erilaistumisen säätelyssä. Tässä tutkimuksessa tutkijat pyrkivät tutkimaan Ctdnep1:n, fosfataasin (entsyymi, joka poistaa fosfaattiryhmiä), roolia, jonka on raportoitu estävän BMP- ja TGF-β-signalointireittejä.
Tutkimus julkaistiin lehdessä Biochemical and Biophysical Research Communications.
Professori Hayata toteaa: "RANKL toimii 'kiihdyttimenä' osteoklastien erilaistumisessa. Autolla ajaminen vaatii paitsi kaasupolkimen myös jarruja. Tässä havaitsimme, että Ctdnep1 toimii 'jarruna' osteoklastien erilaistumisessa." p>
Tutkijat tutkivat ensin Ctdnep1:n ilmentymistä RANKL:llä käsiteltyjen hiirten makrofageissa ja kontrollisoluissa ilman hoitoa. He totesivat, että Ctdnep1:n ilmentyminen ei muuttunut vasteena RANKL-stimulaatiolle. Se kuitenkin lokalisoitui sytoplasmaan rakeisessa muodossa makrofageissa ja erilaistui osteoklasteiksi, mikä poikkesi sen normaalista perinukleaarisesta lokalisaatiosta muissa solutyypeissä, mikä viittaa sen sytoplasmiseen toimintaan osteoklastien erilaistumisessa.
Lisäksi Ctdnep1-poisto (geenin alasäätely) johti tartraattiresistentin happaman fosfataasin (TRAP) positiivisten osteoklastien määrän kasvuun, jossa TRAP on erilaistuneiden osteoklastien merkki.
Ctdnep1-poisto johti avainerilaistumismarkkerien lisääntyneeseen ilmentymiseen, mukaan lukien "Nfatc1", RANKL:n indusoima päätranskriptiotekijä osteoklastien erilaistumiseen. Nämä tulokset tukevat Ctdnep1:n "inhiboivaa toimintaa", jolloin se säätelee negatiivisesti osteoklastien erilaistumista. Lisäksi Ctdnep1:n poistaminen johti myös lisääntyneeseen kalsiumfosfaatin imeytymiseen, mikä viittaa Ctdnep1:n estävään rooliin luun resorptiossa.
Lopuksi, vaikka Ctdnep1-poisto ei muuttanut BMP- ja TGF-β-signalointireittejä, Ctdnep1-puutteiset solut osoittivat lisääntyneitä fosforyloitujen (aktivoitujen) proteiinien tasoja, jotka ovat RANKL-signalointireitin tuotteita. Nämä tulokset viittaavat siihen, että Ctdnep1:n estävä vaikutus osteoklastien erilaistumiseen ei välttämättä välity BMP- ja TGF-β-signalointireittien kautta, vaan RANKL-signalointireitin ja Nfatc1-proteiinitasojen negatiivisen säätelyn kautta.
Kaiken kaikkiaan nämä tulokset tarjoavat uusia näkemyksiä osteoklastien erilaistumisprosessista ja tunnistavat mahdollisia terapeuttisia kohteita, joita voidaan käyttää sellaisten hoitojen kehittämiseen, joilla pyritään vähentämään osteoklastien yliaktiivisuudesta johtuvaa luukatoa. Luukadosta luonnehtivien sairauksien lisäksi Ctdnep1 on tunnistettu myös syytekijäksi medulloblastoomassa, lapsuuden aivokasvaimessa. Kirjoittajat ovat optimistisia, että heidän tutkimustaan voidaan laajentaa muihin ihmisten sairauksiin kuin luuaineenvaihduntaan.
Professori Hayata päättelee: "Tuloksemme viittaavat siihen, että Ctdnep1:tä tarvitaan estämään liiallista osteoklastogeneesiä. Nämä tulokset voivat edelleen laajentaa tietoa siitä, kuinka fosforylaatio-defosforylaatioverkosto säätelee osteoklastien erilaistumista ja voi tarjota uusia terapeuttisia strategioita luusairauksien hoitoon. Liiallinen osteoklastien aktiivisuus."
