Uudet julkaisut
Uusi näkökulma neurodegeneraatioon: neurokemiallisen T14:n rooli Alzheimerin taudissa.
Viimeksi tarkistettu: 02.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Kansainvälinen kliinikoiden ja neurotieteilijöiden ryhmä on julkaissut uuden katsausartikkelin neurodegeneraatioprosessista. Heidän löydöksensä tutkivat amyloidin muodostumista edeltävää mekanismia, mukaan lukien keskeistä neurokemikaalia, joka edistää prosessia.
Alzheimer's & Dementia -lehdessä julkaistu tutkimus keskittyy isodendriittisiin tumakkeisiin, jotka ovat muista aivosoluista poikkeavia hermosoluja ja joiden on aiemmin tunnistettu olevan erityisen alttiita Alzheimerin taudille.
Kirjoittajat myöntävät, että amyloidi on merkittävä tekijä Alzheimerin taudin myöhäisvaiheessa, mutta huomauttavat, että sitä ei esiinny näissä neuroneissa varhaisessa vaiheessa. Jos näille haavoittuville neuroneille aiheutuu vaurioita aikuisuudessa, ne reagoivat mobilisoimalla vastemekanismin. Tämä mekanismi tyypillisesti edistää neuronien kasvua sikiö- ja varhaislapsuudessa, mutta on haitallista aikuisuudessa.
Katsauksessa kuvataan, kuinka tätä prosessia ajava keskeinen molekyyli on bioaktiivinen 14-meeripeptidi T14, joka aktivoi selektiivisesti yhden kohdereseptorin. Kypsässä aivossa normaalin toiminnan palauttamisen sijaan T14 aiheuttaa hermosolujen kuoleman ja käynnistää negatiivisen lumipalloreaktion, joka vahvistuu ajan myötä.
Syvällä aivoissa sijaitsevat isodendriittitumakkeet vastaavat vireystilasta ja uni-valveillaolosykleistä, eivätkä ne ole suoraan yhteydessä korkeampiin toimintoihin, kuten muistiin. Näin ollen rappeutumisprosessi voi jatkua ilman ilmeisiä oireita, kunnes vaurio leviää kognitiosta vastaaville alueille.
Artikkelissa esitetty selitys voisi selittää pitkän, 10–20 vuoden viiveen hermosolujen häviämisen alkamisesta kognitiivisten häiriöiden alkamiseen.
Katsauksessa todetaan, että T14 voidaan havaita Alzheimerin taudin hyvin varhaisessa vaiheessa, mikä voi toimia oireettomana merkkinä neurodegeneraation alkamisesta ja sitä voitaisiin siten kehittää biomarkkeriksi.
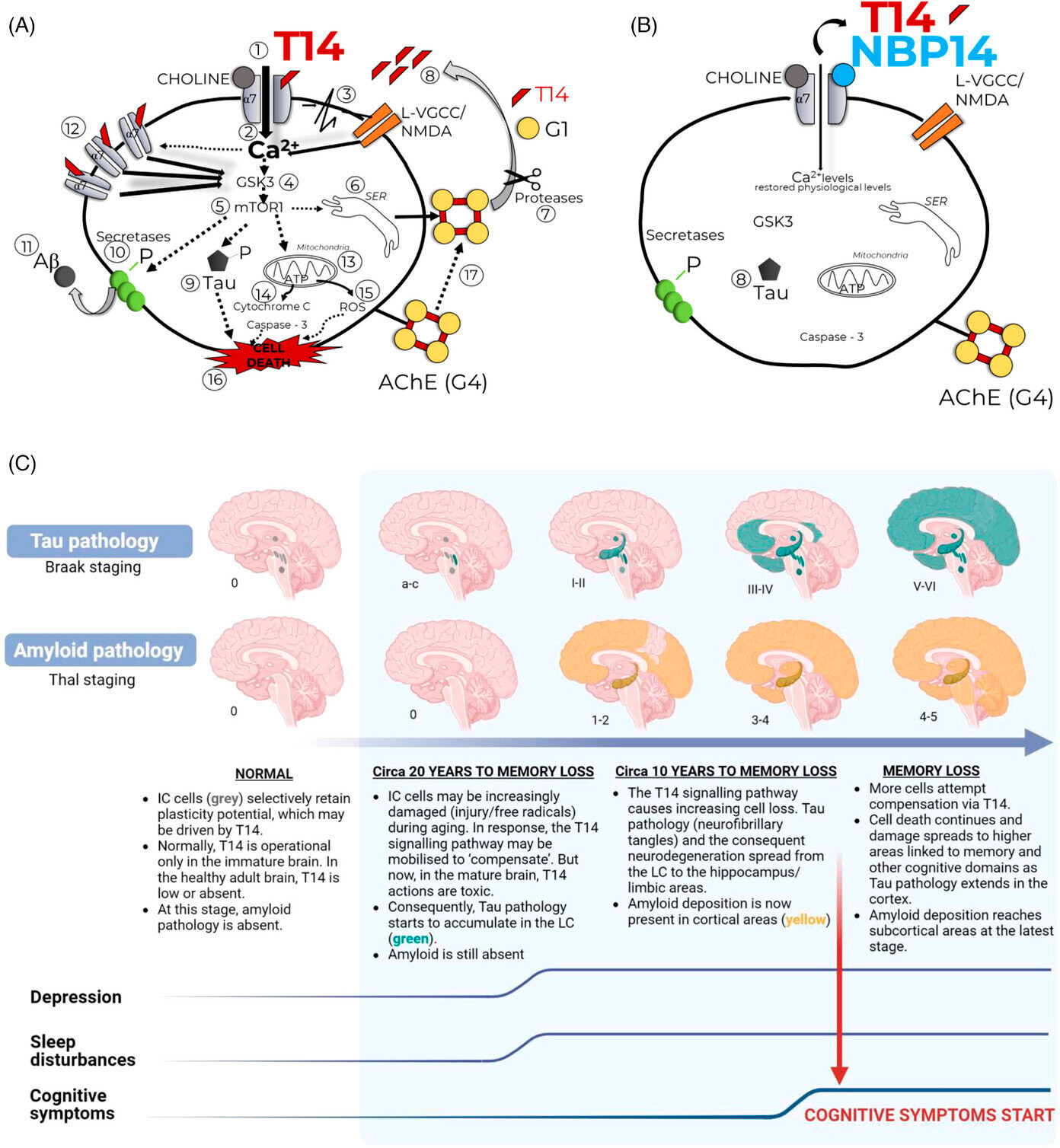
Lisäksi kirjoittajat kuvaavat, kuinka syklisoitunut T14-muoto, NBP14, voi estää T14:n toiminnan. NBP14:n on osoitettu estävän muistin heikkenemistä Alzheimerin taudin hiirimallissa, ja sen vaikutusmekanismi on osoitettu useissa tutkimuksissa, mukaan lukien ihmisen aivokudoksen post mortem -tutkimukset. Siten NBP14 voi muodostaa perustan uudelle hoitostrategialle.
Tämä uusi lähestymistapa tarjoaa tärkeitä löytöjä, jotka voisivat merkittävästi vaikuttaa Alzheimerin taudin varhaiseen diagnosointiin ja hoitoon, mikä korostaa lisätutkimuksen tärkeyttä tällä alalla.
