Uudet julkaisut
Tutkijat löysivät uuden immunosuppressiivisen mekanismin aivosyövässä
Viimeksi tarkistettu: 02.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Apulaisprofessori Filippo Veglia ja hänen tiiminsä Wistar-instituutissa ovat löytäneet keskeisen mekanismin, jolla glioblastooma – vakava ja usein kuolemaan johtava aivosyöpä – tukahduttaa immuunijärjestelmän, jotta kasvain voi kasvaa estämättä elimistön puolustusjärjestelmää.
Heidän löytönsä julkaistiin artikkelissa "Glukoosi-driven histone lactylation promotes the immunosuppressive activity of monocyte-derived macrophages in glioblastooma" lehdessä Immunity.
"Tutkimuksemme osoittaa, että syövän itseään ylläpitävät mekanismit, jos ne ymmärretään riittävästi, voidaan valjastaa tautia vastaan erittäin tehokkaasti", sanoi tohtori Veglia.
"Odotan innolla tulevia tutkimuksia aineenvaihdunnan välittämistä immuunisuppressiomekanismeista glioblastoomassa ja toivon, että opimme jatkossakin lisää siitä, miten tätä syöpää voidaan ymmärtää ja torjua paremmin."
Tähän mennessä on tutkittu vain vähän sitä, miten monosyyteistä peräisin olevat makrofagit ja mikroglia luovat immuunivastetta heikentävän kasvainmikroympäristön glioblastoomassa.
Veglian laboratorio tutki glioblastooman solutason immuunisuppressiomekanismeja ja havaitsi, että glioblastooman edetessä monosyyteistä peräisin olevien makrofagien määrä alkaa ylittää mikroglian määrän. Tämä viittaa siihen, että monosyyteistä peräisin olevien makrofagien hallitseva osuus kasvaimen mikroympäristössä on syöpään hyödyllinen immuunivasteen välttämisen kannalta.
Todellakin, monosyyteistä peräisin olevat makrofagit, mutta eivät mikroglia, estivät T-solujen (kasvainsoluja tappavien immuunisolujen) aktiivisuuden prekliinisissä malleissa ja potilailla. Tutkimusryhmä vahvisti tämän arvioimalla prekliinisiä glioblastoomamalleja, joissa oli keinotekoisesti vähennetty määrä monosyyteistä peräisin olevia makrofageja.
Kuten odotettua, mallit, joissa kasvaimen mikroympäristössä oli vähemmän pahanlaatuisia makrofageja, osoittivat parempia tuloksia verrattuna tavanomaisiin glioblastoomamalleihin.
Glioblastooma muodostaa hieman yli puolet kaikista aivoissa syntyvistä pahanlaatuisista kasvaimista, ja tautia sairastavien potilaiden ennuste on erittäin huono: vain 25 % potilaista selviää hengissä ensimmäisen vuoden ajan diagnoosin jälkeen. Glioblastooma on vaarallinen paitsi sijaintinsa aivoissa myös immuunivastetta heikentävän kasvainmikroympäristön vuoksi, mikä tekee glioblastoomasta resistentin lupaaville immunoterapioille.
Ohjelmoimalla tiettyjä immuunisoluja, kuten makrofageja (monosyyteistä peräisin olevia makrofageja ja mikrogliaa), toimimaan kasvaimen puolesta eikä sitä vastaan, glioblastooma luo itselleen kasvaimen mikroympäristön, joka sallii syövän kasvaa aggressiivisesti ja välttää syöpää estäviä immuunivasteita.
Mekanismin selvennys
Vahvistettuaan monosyyteistä peräisin olevien makrofagien roolin Weglian laboratorio pyrki sitten ymmärtämään tarkalleen, miten nämä syöpään liittyvät immuunisolut toimivat immuunijärjestelmää vastaan.
He sekvensoivat makrofagit selvittääkseen, oliko soluissa poikkeavia geenien ilmentymismalleja, jotka saattaisivat viitata immuunisuppressioon vaikuttaviin geeneihin, ja he tutkivat myös makrofagien aineenvaihduntamalleja selvittääkseen, liittyikö poikkeava geenien ilmentyminen aineenvaihduntaan.
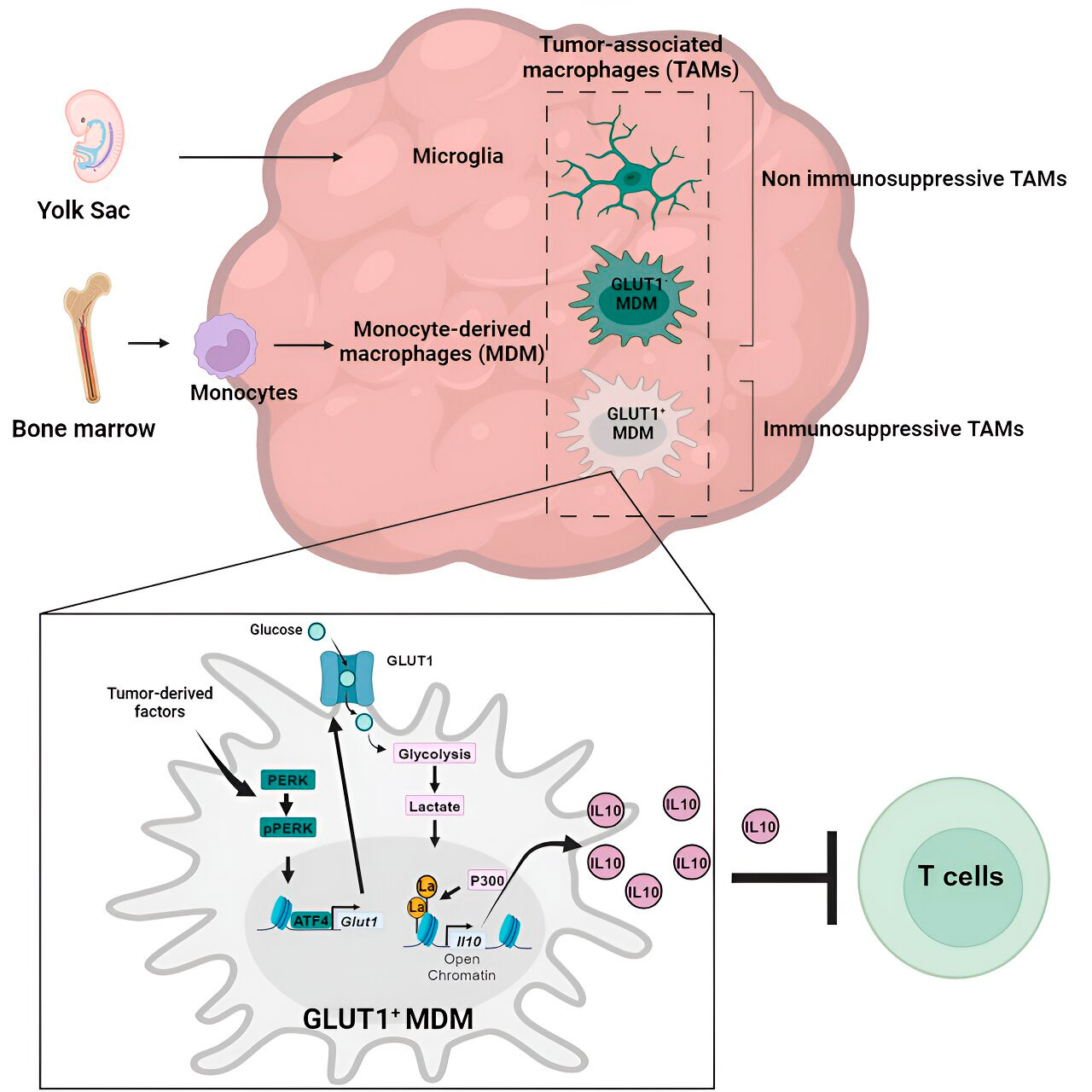
Geeni- ja aineenvaihdunta-analyysi johti heidät glukoosiaineenvaihduntaan. Sarja testejä osoitti, että monosyyteistä peräisin olevat makrofagit, joilla oli lisääntynyt glukoosiaineenvaihdunta ja GLUT1:n, glukoosin tärkeimmän kuljettajan, ilmentyminen, estivät T-solujen toimintaa vapauttamalla interleukiini-10:tä (IL-10).
Tiimi osoitti, että glioblastooma häiritsee näiden makrofagien glukoosiaineenvaihduntaa, mikä aiheuttaa niiden immunosuppressiivista aktiivisuutta.
Histonin laktylaatio ja sen rooli
Tutkijat havaitsivat, että monosyyteistä peräisin olevien makrofagien glukoosiaineenvaihduntaan liittyvän immunosuppressiivisen aktiivisuuden avain on prosessissa, jota kutsutaan "histonilaktylaatioksi". Histonit ovat genomin rakenneproteiineja, joilla on keskeinen rooli geenien, kuten IL-10:n, ilmentymisessä tietyissä yhteyksissä.
Metabolisoimalla glukoosia nopeasti monosyyteistä peräisin olevat makrofagit tuottavat laktaattia, glukoosiaineenvaihdunnan sivutuotetta. Histonit voivat "laktyloitua" (eli laktaatti integroituu histoneihin) siten, että histoniorganisaatio edistää IL-10:n ilmentymistä, jota monosyyteistä peräisin olevat makrofagit tuottavat syöpäsolujen kasvun tukemiseksi.
Ratkaisu ongelmaan
Mutta miten monosyyteistä peräisin olevien makrofagien glukoosiaineenvaihduntaan liittyvä immunosuppressiivinen toiminta voidaan pysäyttää? Tohtori Veglia ja hänen tiiminsä löysivät mahdollisen ratkaisun: PERKin, entsyymin, jonka he tunnistivat glukoosiaineenvaihdunnan ja GLUT1:n ilmentymisen säätelijäksi makrofageissa.
Glioblastooman prekliinisissä malleissa PERK-histonilaktylaatioon ja makrofagien immunosuppressiiviseen aktiivisuuteen kohdistuva hoito esti glioblastooman etenemisen ja indusoi pitkäaikaisen immuniteetin, joka suojasi aivoja kasvaimen uudelleenkasvulta. Tämä viittaa siihen, että PERK-histonilaktylaatioakseliin kohdistuva hoito voi olla käyttökelpoinen strategia tämän tappavan aivosyövän torjumiseksi. Yhdessä immunoterapian kanssa PERK-histonilaktylaatioakseliin kohdistuva hoito voi olla mahdollinen strategia tämän tappavan aivosyövän torjumiseksi.
