Uudet julkaisut
ARID1A-geenin mutaatio tekee kasvaimista herkkiä immunoterapialle.
Viimeksi tarkistettu: 02.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Immunoterapia on mullistanut syövän hoidon viime vuosina. Sen sijaan, että immunoterapia kohdistaisi hoitoja suoraan kasvaimiin, se ohjaa potilaiden immuunijärjestelmää hyökkäämään tehokkaammin kasvaimia vastaan. Tämä on erityisen tehokasta joidenkin vaikeasti hoidettavien syöpien hoidossa. Alle puolet kaikista syöpäpotilaista reagoi kuitenkin nykyisiin immunoterapioihin, mikä luo kiireellisen tarpeen tunnistaa biomarkkereita, jotka voivat ennustaa, mitkä potilaat todennäköisimmin hyötyvät hoidosta.
Viime aikoina tutkijat ovat huomanneet, että potilaat, joiden kasvaimissa on mutaatio ARID1A-geenissä, reagoivat todennäköisemmin positiivisesti immuunitarkastuspisteiden salpaukseen, joka on eräänlainen immunoterapia, joka toimii pitämällä syöpää torjuvat immuunisolut aktivoituina.
Koska ARID1A-geenimutaatiota esiintyy monissa syöpätyypeissä, kuten endometrium-, munasarja-, paksusuolen-, mahalaukun, maksan ja haiman syövissä, Salk-instituutin tutkijat pohtivat, miten se voisi vaikuttaa hoidon herkkyyteen ja miten lääkärit voisivat käyttää tätä tietoa syöpähoidon personointiin kullekin potilaalle.
Heidän uusi tutkimuksensa, joka julkaistiin Cell-lehdessä, osoittaa, että ARID1A-mutaatio tekee kasvaimista herkkiä immunoterapialle rekrytoimalla syöpää torjuvia immuunisoluja kasvaimeen antiviraalisen kaltaisen immuunivasteen kautta.
Tutkijat ehdottavat, että tätä mutaatiota ja antiviraalista immuunivastetta voitaisiin käyttää biomarkkerina potilaiden paremman valinnan mahdollistamiseksi tiettyihin immunoterapioihin, kuten immuunitarkastuspisteiden estämiseen. Nämä löydökset kannustavat myös sellaisten lääkkeiden kehittämiseen, jotka kohdistuvat ARID1A:han ja siihen liittyviin proteiineihin, jotta muut kasvaimet herkistyisivät immunoterapialle.
”Tämä voisi todella muuttaa syöpähoidon tuloksia potilailla”, sanoo tutkimuksen vanhempi kirjoittaja, apulaisprofessori Diana Hargreaves. ”ARID1A-mutaatiota sairastavilla potilailla on jo immuunivaste, joten meidän tarvitsee vain tehostaa tätä vastetta immuunitarkastuspisteiden estämisellä, jotta he voivat tuhota kasvaimensa sisältäpäin.”
Vaikka tiedettiin, että ARID1A-mutaatioita kantavat ihmiset reagoivat hyvin immuunitarkastuspisteiden estoon, tarkka yhteys näiden kahden välillä pysyi epäselvänä. Selventääkseen mekanismia Salk-instituutin tutkijat käyttivät melanooman ja paksusuolen syövän hiirimalleja, joissa oli sekä ARID1A-mutaatio että toiminnallinen ARID1A.
Lähde: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Tutkimusryhmä havaitsi voimakkaan immuunivasteen kaikissa ARID1A-mutaatiota sisältävissä malleissa, mutta ei niissä, joissa ARID1A oli toiminnassa. Tämä tukee ajatusta siitä, että ARID1A-mutaatio todellakin ohjaa tätä vastetta. Mutta miten tämä toimii molekyylitasolla?
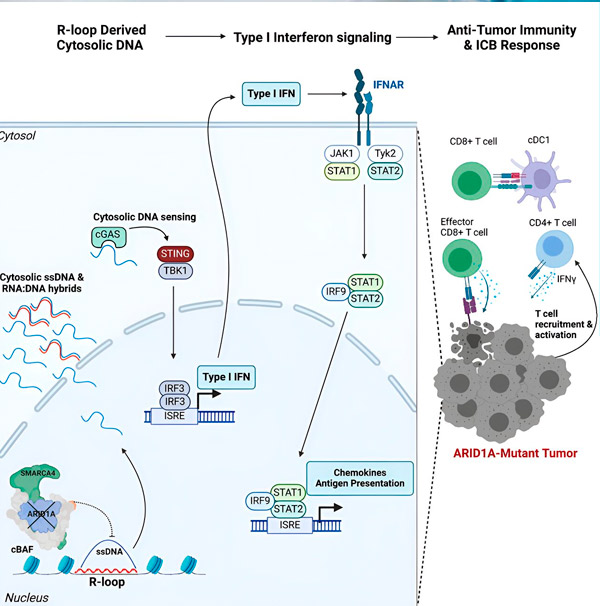
"Havaitsimme, että ARID1A:lla on tärkeä rooli tumassa ylläpitämällä DNA:n asianmukaista organisaatiota", sanoo Matthew Maxwell, tutkimuksen ensimmäinen kirjoittaja ja Hargreavesin laboratorion jatko-opiskelija. "Ilman toimivaa ARID1A:ta vapaa DNA voi irrota ja vapautua sytosoliin, mikä aktivoi toivotun antiviraalisen immuunivasteen, jota voidaan tehostaa immuunitarkastuspisteiden estolla."
ARID1A-geeni koodaa proteiinia, joka auttaa säätelemään DNA:n muotoa ja ylläpitämään genomin vakautta. Kun ARID1A mutatoituu, se käynnistää Rube Goldbergin kaltaisen tapahtumaketjun syöpäsoluissa.
Ensinnäkin toiminnallisen ARID1A:n puute johtaa DNA:n vapautumiseen sytosoliin. Sytosolinen DNA aktivoi sitten antiviraalisen hälytysjärjestelmän, cGAS-STING-reitin, koska solumme ovat sopeutuneet merkitsemään minkä tahansa sytosolissa olevan DNA:n vieraaksi suojatakseen virusinfektioilta. Lopulta cGAS-STING-reitti aktivoi immuunijärjestelmän rekrytoimaan T-soluja kasvaimeen ja aktivoimaan ne erikoistuneiksi syöpää tappaviksi T-soluiksi.
Jokaisessa vaiheessa, edellisestä vaiheesta riippuen, tämä tapahtumaketju – ARID1A-mutaatio, DNA:n poistuminen, cGAS-STING-hälytys, T-solujen rekrytointi – johtaa syöpää vastaan taistelevien T-solujen määrän kasvuun kasvaimessa. Immuunitarkastuspisteiden salpausta voidaan sitten käyttää varmistamaan, että nämä T-solut pysyvät aktivoituneina, mikä parantaa niiden kykyä voittaa syöpä.
”Löydöksemme tarjoavat uuden molekyylitason mekanismin, jolla ARID1A-mutaatio voi edistää kasvaimia estävää immuunivastetta”, Hargreaves sanoo. ”Näissä löydöksissä on jännittävää niiden translaatiopotentiaali. Voimme käyttää ARID1A-mutaatioita potilaiden valitsemiseen immuunitarkastuspisteiden salpausta varten, ja näemme nyt mekanismin, jolla ARID1A:ta tai sen proteiinikompleksia estäviä lääkkeitä voitaisiin käyttää immunoterapian tehostamiseen muilla potilailla.”
Kuvaamalla mekanismin, jolla immuunitarkastuspisteiden esto on tehokkaampaa ARID1A-mutaatioituneiden syöpien hoidossa, tutkijat tarjoavat kliinikoille perustelut tämän immunoterapian priorisoinnille ARID1A-mutaatiota sairastavilla potilailla. Nämä löydökset ovat tärkeä askel kohti syöpähoidon yksilöllistämistä ja inspiroivat uusien ARID1A:han ja sen proteiinikompleksiin kohdistuvien hoitojen kehittämistä.
Jatkossa Salk-instituutin tiimi toivoo löydöstensä parantavan ARID1A-mutaatioihin liittyvien erityyppisten syöpien hoitotuloksia ja aikoo tutkia tätä kliinistä soveltamista yhteistyössä Kalifornian yliopiston San Diegon kanssa.
