Uudet julkaisut
Tutkijat ovat luoneet "kameleonttiyhdisteen" lääkkeille vastustuskykyisten aivosyöpien hoitoon.
Viimeksi tarkistettu: 02.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Yalen yliopiston tutkijoiden uusi tutkimus kuvaa, kuinka uusi kemiallinen yhdiste hyökkää lääkeresistenttien aivokasvainten kimppuun vahingoittamatta ympäröivää tervettä kudosta.
Journal of the American Chemical Society -lehdessä julkaistu tutkimus on tärkeä askel niin kutsuttujen "kameleonttiyhdisteiden" kehittämisessä, joita voitaisiin käyttää useiden vaarallisten syöpien torjuntaan.
Glioomaa kehittyy vuosittain noin 6,6:lla 100 000 ihmistä kohden ja 14 vuoden ikään mennessä 2,94:llä 100 000 ihmistä kohden. Lukuun ottamatta muiden syöpien keskushermostoon leviäviä etäpesäkkeitä, glioomat muodostavat 26 % kaikista aivokasvaimista (primaariset aivokasvaimet) ja 81 % kaikista pahanlaatuisista aivokasvaimista.
Glioblastoomapotilaita on vuosikymmenten ajan hoidettu temotsolomidi-nimisellä lääkkeellä. Useimmat potilaat kehittävät kuitenkin resistenssin temotsolomidille vuoden kuluessa. Glioblastoomapotilaiden viiden vuoden eloonjäämisaste on alle 5 %.
Vuonna 2022 Yalen kemisti Seth Herzon ja sädehoidon erikoislääkäri, tohtori Ranjit Bindra, kehittivät uuden strategian glioblastoomien tehokkaampaan hoitoon. He loivat kameleonttiyhdisteiksi kutsuttujen syöpää ehkäisevien molekyylien luokan, jotka hyödyntävät O6-metyyliguaniini-DNA-metyylitransferaasina (MGMT) tunnetun DNA:n korjausproteiinin vikaa.
Monilta syöpäsoluilta, mukaan lukien glioblastoomilta, puuttuu MGMT-proteiini. Uudet kameleonttiyhdisteet on suunniteltu vahingoittamaan DNA:ta kasvainsoluissa, joista puuttuu MGMT.
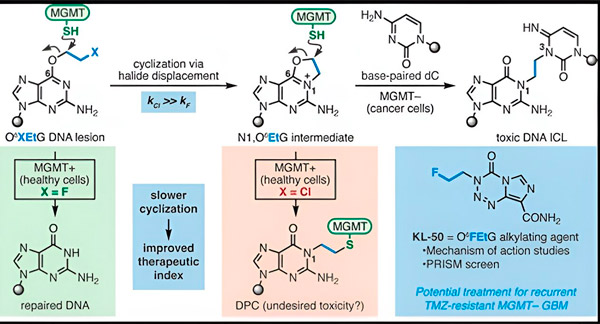
Kameleonttiyhdisteet aiheuttavat DNA-vaurioita aiheuttamalla primaarisia leesioita DNA:han, jotka ajan myötä kehittyvät erittäin myrkyllisiksi sekundaarisiksi leesioksi, joita kutsutaan säikeiden välisiksi ristisidoksiksi. MGMT suojaa terveiden kudosten DNA:ta korjaamalla primaarisia leesioita ennen kuin ne voivat kehittyä tappaviksi säikeiden välisiksi ristisidoksiksi.
Uudessa tutkimuksessaan tutkijatohtorit Herzon ja Bindra keskittyivät pääkameleonttiinsa, KL-50:een.
"Käytimme synteettisen kemian ja molekyylibiologian tutkimusten yhdistelmää selvittääksemme aiempien havaintojemme molekyylitason perustan sekä kemiallisen kinetiikan, joka tarjoaa näiden yhdisteiden ainutlaatuisen selektiivisyyden", sanoi Herzon, Yalen yliopiston Milton Harrisin kemian professori. "Osoitamme, että KL-50 on ainutlaatuinen siinä mielessä, että se muodostaa DNA-ristisidoksia vain kasvaimissa, joissa on viallinen DNA:n korjaus. Se säästää tervettä kudosta."
Lähde: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Tutkijoiden mukaan se on merkittävä ero. Useita muita syöpää ehkäiseviä yhdisteitä on suunniteltu laukaisemaan säikeiden välisiä ristisidoksia, mutta ne eivät ole selektiivisiä kasvainsoluille, mikä rajoittaa niiden hyödyllisyyttä.
Tutkijoiden mukaan KL-50:n menestyksen salaisuus on sen ajoitus. KL-50 muodostaa säikeiden välisiä ristisidoksia hitaammin kuin muut ristisidokset. Tämä viive antaa terveille soluille riittävästi aikaa käyttää MGMT:tä ristisidosten muodostumisen estämiseksi.
”Tämä ainutlaatuinen profiili viittaa sen potentiaaliin lääkeresistentin glioblastooman hoidossa, jolla on suuri kliininen tarve”, sanoi Bindra, Yalen lääketieteellisen tiedekunnan Harvey and Kate Cushing -professori terapeuttisessa radiologiassa. Bindra on myös Smilo-sairaalan Chenevertin perheen aivokasvainkeskuksen tieteellinen johtaja.
Herzon ja Bindra sanoivat tutkimuksensa korostavan kemiallisen DNA-modifikaation ja biokemiallisen DNA-korjauksen nopeuden huomioon ottamisen tärkeyttä. He uskovat voivansa käyttää tätä strategiaa kehittääkseen hoitoja muihin syöpiin, joissa on tiettyjä kasvaimeen liittyviä DNA-korjausvirheitä.
