Uudet julkaisut
FDA:n hyväksymä TIVDAK®: Kudostekijän kohdentaminen kohdunkaulan syövässä
Viimeksi tarkistettu: 02.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Yhdysvaltain elintarvike- ja lääkevirasto (FDA) myönsi 29. huhtikuuta 2024 täyden hyväksynnän Seagen Inc:n TIVDAK®-valmisteelle (tisotumabi-vedotiini), joka on kudostekijään (TF) kohdistuva lääke, uusiutuneen tai metastaattisen kohdunkaulan syövän hoitoon potilailla, jotka ovat edenneetkemoterapian aikana tai sen jälkeen. Tämä on merkittävä läpimurto kohdunkaulan syövän hoidossa ja korostaa vasta-aine-lääkekonjugaattien (ADC) potentiaalia onkologiassa.
TIVDAKin vaikutusmekanismi
Tivdak on ADC, joka kohdistuu TF:ään yhdistämällä Genmabin TF:n vastaisen monoklonaalisen vasta-aineen tisotumabin Seagenin ADC-teknologiaan, joka on suunniteltu kohdistamaan TF-antigeenit syöpäsolujen pinnalla ja toimittamaan sytotoksista komponenttia, MMAE:tä, suoraan syöpäsoluihin.
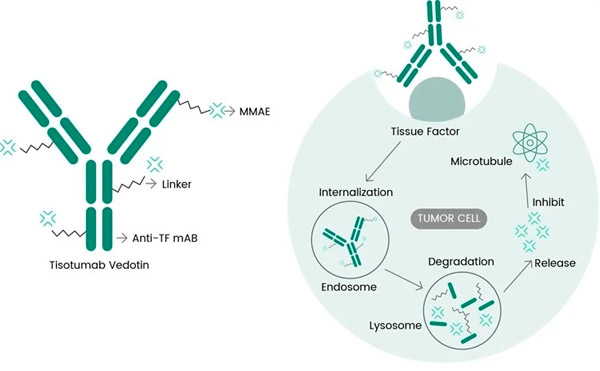
Tisotumabi-vedotiinin molekyylitason vaikutusmekanismi ( https://doi.org/10.3390/ijms23073559 )
TF: Täydellinen kohde ADC-kehitykselle
TF:n tiedetään osallistuvan kasvainten signalointiin ja angiogeneesiin, ja sitä ilmentyy yli valtaosalla kohdunkaulan syöpää ja monia muita kiinteitä kasvaimia sairastavista potilaista. Sen kyky imeytyä nopeasti elimistöstä vasta-aineiden sitoutumisen jälkeen ja sen minimaalinen vaikutus normaaliin veren hyytymiseen parantavat entisestään sen soveltuvuutta kohdennettuun syöpähoitoon.
