Uudet julkaisut
FDA hyväksyy ensimmäisen voidemaisen hoidon krooniseen käsi-ihottumaan
Viimeksi tarkistettu: 27.07.2025

Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
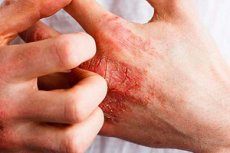
Yhdysvaltain elintarvike- ja lääkevirasto (FDA) on hyväksynyt ensimmäisen kroonisen käsi-ihottuman hoitoon tarkoitetun voiteen.
CHE on yleinen tila, jolle on ominaista punainen, kutiava ja halkeileva iho käsissä ja ranteissa.
Anzupgo (delgositinibivoide) on hyväksytty aikuisille, joilla on keskivaikea tai vaikea CHE-embolia ja jotka eivät voi käyttää paikallisia steroideja tai joille ne eivät ole tehonneet.
”Anzupgon hyväksyntä vahvistaa sitoutumisemme investoimaan vaikeasti hoidettaviin ihosairauksiin, jotta voimme tuoda uusia hoitoja potilaille siellä, missä niitä eniten tarvitaan”, Anzupgon valmistajan LEO Pharman toimitusjohtaja Christophe Bourdon sanoi lehdistötiedotteessa.
Toisin kuin atooppinen ihottuma, yleisin ekseeman muoto, CHE on harvinainen ja heikentävä sairaus. Se vaikuttaa noin 10 prosenttiin Yhdysvaltain väestöstä ja kestää yli kolme kuukautta tai pahenee vähintään kaksi kertaa vuodessa National Eczema Associationin mukaan.
Anzupgo toimii estämällä JAK-entsyymejä, jotka aiheuttavat tulehdusta, joka laukaisee käsi-ihottuman pahenemisvaiheita.
Geneettinen alttius sekä altistuminen ärsyttäville aineille ja allergeeneille voivat johtaa tämän ekseeman muodon kehittymiseen. Riskiryhmässä ovat ne, jotka työskentelevät esimerkiksi siivous-, kampaamo- ja terveydenhuoltoaloilla, joilla he todennäköisemmin joutuvat kosketuksiin kemikaalien kanssa ja reagoivat niihin.
Tutkimukset osoittavat, että tällä sairaudella on vakava vaikutus ihmisen elämänlaatuun ja mielenterveyteen.
Detroitin ihotautilääkäri kiitti FDA:n päätöstä.
”Ihotautilääkärinä työskennellessäni olen nähnyt omin silmin, kuinka paljon potilaat kärsivät CHE:n aiheuttamasta kutinasta ja kivusta ja kuinka paljon vaikeuksia heillä on jokapäiväisessä elämässään”, sanoi tohtori Linda Stein Gold, kliinisen tutkimuksen johtaja Henry Ford Healthissa Detroitissa, LEO Pharma US:n lehdistötiedotteessa. ”Uskon, että tämä uusi hoitovaihtoehto otetaan mielellään vastaan ihotautilääkärien keskuudessa, jotka etsivät tehokkaita ja turvallisia tapoja hallita näitä oireita.”
Ennen FDA:n hyväksyntää tehdyt tutkimukset osoittivat, että voidetta käyttäneet käsi-ihottumasta kärsivät kokivat paranemista useammin kuin lumelääkettä tai lumevoidetta käyttäneet. Lääkkeessä ei ole mustan laatikon varoitusta, jota vaaditaan muilla paikallisesti ja suun kautta otettavilla JAK-estäjillä.
”Olemme innoissamme siitä, että FDA on tunnustanut keskivaikean tai vaikean kroonisen käsi-ihottuman vaikutuksen potilaisiin”, sanoi Christine Belleson, National Eczema Associationin toimitusjohtaja ja puheenjohtaja, lehdistötiedotteessa.
”Tämän heikentävän käsien ihosairauden kanssa eläville ihmisille se on äärimmäisen vaikeaa; se vaikuttaa heidän kykyynsä työskennellä, koskettaa muita ja olla yhteydessä heille tärkeisiin ihmisiin”, hän lisäsi. ”Tämä suositus tuo toivoa ja näkökulmaa ekseeman yhteisölle ja niille, jotka etsivät pysyvää helpotusta tuhoisiin oireisiin.”
Voide on jo hyväksytty Euroopan unionissa, Isossa-Britanniassa, Sveitsissä ja Yhdistyneissä arabiemiirikunnissa.
